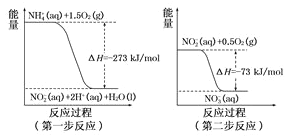
��Ŀ����
����Ŀ���״�����Ҫ�Ļ���ԭ��,����ú������������CO��H2����ȡ�״��������ķ�ӦΪCO(g)+2H2(g) ![]() CH3OH(g) ��H=-99kJ/mol��
CH3OH(g) ��H=-99kJ/mol��
��1�����ڸ÷�Ӧ������˵��,�������___________��
A.����CO������CH3OH���������ʱ��˵���÷�Ӧ�ﵽƽ��״̬
B.�����¶�,����Ӧ���ʼ�С���淴Ӧ��������
C.ʹ�ô������������CO��ת����
D.����ѹǿ���÷�Ӧ�Ļ�ѧƽ�ⳣ������
��2����ij�¶�ʱ����1.0mol CO ��2.0 mol H2����2 L�Ŀո�ƿ��,����������Ӧ,�ڵ�5 minʱ�ﵽ��ѧƽ��״̬����ʱ�״������ʵ�������Ϊ10%���״�Ũ�ȵı仯״����ͼ��ʾ:

�ٴӷ�Ӧ��ʼ��5 min ʱ�����ɼ״���ƽ������Ϊ________��
��5 min ʱ�ﵽƽ�⣬H2��ƽ��ת���ʦ�=_____%.��ѧƽ�ⳣ��K= _______��
��1min ʱ��v��(CH3OH)______ 4min ʱv��(CH3OH ) ������ڡ�С�ڡ����ڡ�����
��������ƿ����ͬ�ݻ��ľ��ȸ�ƿ���ظ�����ʵ�飬ƽ��ʱ�״������ʵ�������_____0.1(�>����<����=��)
���𰸡� B��C 0.025mol/(L��min) 25 0.59 ���� <
����������1������CO������CH3OH���������ʱ��˵����Ӧ�����淴Ӧ������ȣ����Է�Ӧһ����ƽ�⣬ѡ��A��ȷ�������¶�һ�������淴Ӧ���ʶ��ӿ죬����ѡ��B���������ı�ƽ��̬��Ҳ��һ�����ı�ת���ʣ�ѡ��C����ѧ��Ӧƽ�ⳣ��ֻ���¶��йأ���������ѹǿ��ƽ�ⳣ�����䣬ѡ��D��ȷ��
��2��������Ŀ���ݼ������£�
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
��ʼ�� 0.5 1 0
��Ӧ�� X 2X X
ƽ���� 0.5-X 1-2X X �����ϵ�λΪmol/L��
�״������ʵ�������Ϊ10%������![]() ��X=0.125mol/L��
��X=0.125mol/L��
���״�������Ϊ0.125��5=0.025 mol/(L��min)��
�����������㣬��Ӧ������Ϊ2��0.125=0.25��ת����Ϊ0.25��1=25%����ƽ��ʱCO��H2��CH3OH�����ʵ���Ũ�ȷֱ�Ϊ��0.375mol/L��0.75mol/L��0.125mol/L������ƽ�ⳣ��K��0.125/0.375��0.752��0.59��
�۷�Ӧ��ƽ�������ͼ������ͼ��
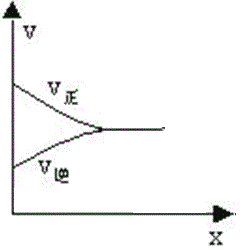
�������ڴ�ƽ��ǰ����������Ӧ���ʴ����������淴Ӧ���ʣ���1minʱ��v��(CH3OH)��4minʱv��(CH3OH)��
��������ƿ����ͬ�ݻ��ľ��ȸ�ƿ���ظ�����ʵ�飬��Ӧ�ų�����������ɢ������ʹ��ϵ�¶�����������Ӧ���ȣ��¶����ߣ�ƽ�������ƶ����״������������С������С��0.1��

 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д�