题目内容
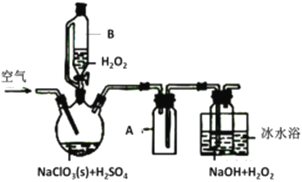
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;③H2O2沸点150℃
请回答:
(1)仪器B的作用是__________________,仪器A的作用是_________________,冰水浴冷却的目的是____________________(写两种)。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO产率,试解释其原因________________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:①_____________________________(用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+
(5)NaClO2纯度测定:①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为____________________。(M(NaClO2)=90.5g/mol)
【答案】 保证恒压滴液漏斗与三颈圆底烧瓶内部压强相同以使得漏斗内液体可以顺利滴下、通过活塞可控制液体滴加的量和速率 防止倒吸 降低NaClO2的溶解度、减少H2O2的分解、增加ClO2的溶解度、减少ClO2的分解(写出两条即可 没有尾气处理装置 空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;空气流速过快时,ClO2不能被充分吸收,导致浪费原料,产率降低 2ClO3-+2Cl-+4H+=2C1O2↑+Cl2↑+2H2O (当最后半滴滴定液滴下后)溶液由无色变蓝色,且30秒内不褪色 90.5%
【解析】(1)装置B为恒压分(滴)液漏斗,因为三颈圆底烧瓶内发生反应生成气体,所以此处使用该装置以保证恒压分(滴)液漏斗与三颈圆底烧瓶内部压强相同以使得漏斗内液体可以顺利滴下并通过活塞控制液体滴加的量和速率。三颈圆底烧瓶内发生反应生成气体,为防止倒吸,右侧导管不能直接伸入溶液中,仪器A的作用是防止倒吸。三颈圆底烧瓶内发生反应生成C1O2,经A装置后进入右侧反应器中,发生反应:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O,用冰水浴冷却,降低了温度,从而降低了NaClO2的溶解度,有利于NaClO2结晶析出;常温时C1O2是气体,降低温度可增加ClO2的溶解度;降低温度,可防止H2O2、ClO2等不稳定的物质分解。
(2)即使用冰水浴冷却右侧反应容器,也不可能将ClO2完全吸收,ClO2为污染性气体,直接排放会污染环境,所以还需要尾气处理装置,这是该装置不完善的地方。
(3)由已知ClO2浓度过高时易发生分解,若空气流速过慢,则ClO2不能被及时移走,浓度过高会导致分解;若空气流速过快,则ClO2不能被充分吸收,所以空气流速过快或过慢,均会导致原料浪费,降低NaClO2的产率。
(4)由已知可得,氯酸钠(NaClO3)在酸性条件下与过氧化氢生二氧化氯,Cl-存在时会催化ClO2的生成,并产生微量氯气,则氯离子与氯酸根离子反应生成ClO2和氯气,故反应离子方程式为:①2ClO3-+2Cl-+4H+=2C1O2↑+Cl2↑+2H2O。
(5)该反应为Na2S2O3标准液滴定碘单质,以淀粉溶液做指示剂,所以当最后一滴(或半滴)滴定液滴下后,溶液由蓝色变为无色且30秒内不褪色;由反应ClO2-+4I-+4H+=2H2O+2I2+Cl-、I2+2S2O32-=2I-+S4O62-,可得关系:ClO2-~2I2~4S2O32-,n(NaClO2)= n(ClO2-)=![]() n(S2O32-)=
n(S2O32-)=![]() ×2.0mol·L-1×20.00×10-3L=0.01mol,因为配制250mL待测溶液,取25.00mL进行实验,所以样品中NaClO2的质量为:0.01mol×90.5g/mol×
×2.0mol·L-1×20.00×10-3L=0.01mol,因为配制250mL待测溶液,取25.00mL进行实验,所以样品中NaClO2的质量为:0.01mol×90.5g/mol×![]() =9.05g,则该样品中NaClO2的质量分数为:9.05g÷10g×100%=90.5%。
=9.05g,则该样品中NaClO2的质量分数为:9.05g÷10g×100%=90.5%。