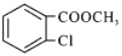
题目内容
【题目】常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列关于溶液中的量的关系判断正确的是
A. H+浓度:10c(H+)甲=c(H+)乙 B. OH-浓度:c(OH-)甲=10c(OH-)乙
C. 溶液浓度:c(甲)>10c(乙) D. 与等量NaOH反应耗酸体积:10V(甲)>V(乙)
【答案】C
【解析】A、甲烧杯中c(H+)=10-amol·L-1,乙烧杯中c(H+)=10-(a+1)mol·L-1,因此由c(H+)甲=10c(H+)乙,故A错误;B、甲烧杯中c(OH-)=Kw/10-amol·L-1,乙烧杯中c(OH-)=Kw/10-(a+1)mol·L-1,则10c(OH-)甲=c(OH-)乙,故B错误;C、根据电离度的定义,甲烧杯中醋酸的物质的量浓度c(CH3COOH)=c(H+)/α1,乙烧杯中醋酸的物质的量浓度c(CH3COOH)=c(H+)/α2,加水稀释,促进醋酸的电离,即α2>α1, ,故C正确;D、因为消耗等量的NaOH溶液,因此有V(甲)×10-a=V(乙)×10-(a+1),即10V(甲)=V(乙),故D错误。
,故C正确;D、因为消耗等量的NaOH溶液,因此有V(甲)×10-a=V(乙)×10-(a+1),即10V(甲)=V(乙),故D错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目