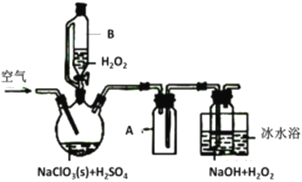
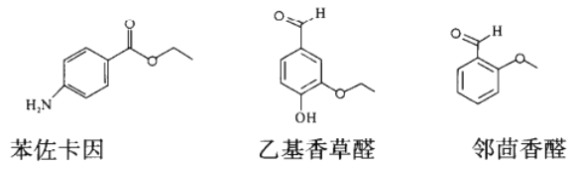
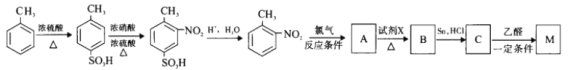
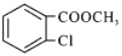
题目内容
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液 体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
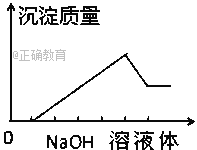
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
【答案】B
【解析】根据图像,可以看出分为4个阶段:第一阶段无沉淀,第二阶段沉淀量逐渐增多到最大量,第三阶段有部分沉淀能和氢氧化钠继续反应,即部分沉淀溶解,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加。第一阶段无沉淀,说明水溶液中一定含有氢离子,故AD错误,第三阶段有部分沉淀能和氢氧化钠继续反应,说明部分沉淀是氢氧化铝,原溶液中一定含有铝离子,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加,说明一定有一种沉淀和氢氧化钠不反应,可推知该沉淀是氢氧化镁,原溶液中一定含有镁离子,铜离子有颜色,与溶液无色不符,故B正确,C错误;故选B。
【题型】单选题
【结束】
14
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
【答案】A
【解析】将适量铁粉放入FeCl3溶液中,完全反应,发生的反应为:Fe+2Fe3+=3Fe2+,已反应的Fe3+的物质的量为x,则
Fe+2Fe3+=3Fe2+
2 3
x 1.5x
溶液中的Fe3+和Fe2+浓度相等,所以,未反应的Fe3+的物质的量为1.5x,所以已反应的Fe3+和未反应的Fe3+的物质的量之比=x:1.5x=2:3,故选A。

【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
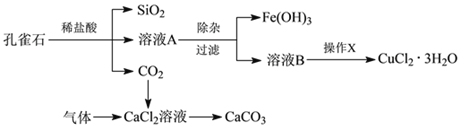
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
物质 | pH (开始沉淀) | pH(完全沉淀) |
Fe(OH)3 | 1.9 | 3.2 |
Fe(OH)2 | 7.0 | 9.0 |
Cu(OH)2 | 4.7 | 6.7 |
(1)在除杂过程时为了除去Fe2+,常加入绿色氧化剂,使Fe2+氧化为Fe3+,此过程涉及的离子方程式为________。
(2)然后再加入适当物质调节溶液的pH至_________ (填写范围),使Fe3+转化为Fe(OH)3,可以达到除去Fe3+,调整溶液pH不可选用下列中的________。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(3)检验Fe(OH)3是否沉淀完全的实验方案是________________________。
(4)操作X包括________、________、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是 ______________。
(5)某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.6g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①读数时,若滴定前平视,滴定后仰视,则所测CaCO3的质量分数将________(选填“偏大”、“偏小”或“无影响”)。
②若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为_______。