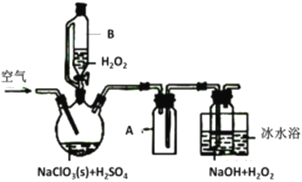
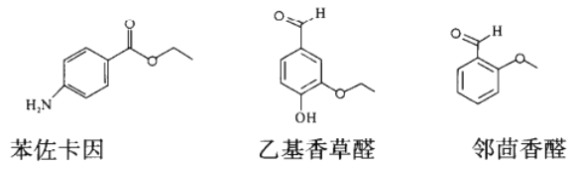
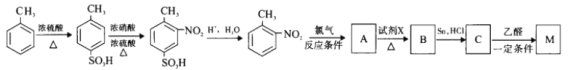
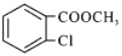
题目内容
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:

下列叙述中不正确的是( )
A. n=0.02 B. V=2240
C. m=3.2 D. 原混合物中FeSO4的质量分数约为89%
【答案】C
【解析】
试题根据流程图,加入铁粉有氢气放出,说明溶液a中有硫酸剩余,步骤①中有氯气反应,说明a中有亚铁离子,17.08gFeSO4和Cu(NO3)2的混合物与0.14mol硫酸反应,硝酸根完全被还原为NO,![]() ,
,![]() ;硝酸铜的质量是0.01mol×188g/mol=1.88g。硫酸亚铁的质量是17.08-1.88=15.2g,其物质的量是0.1mol;
;硝酸铜的质量是0.01mol×188g/mol=1.88g。硫酸亚铁的质量是17.08-1.88=15.2g,其物质的量是0.1mol;
根据方程式
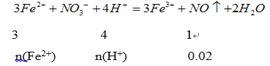
n(Fe2+)=0.06mol、n(H+)=0.08mol,溶液a中n(Fe2+)=0.1-0.06=0.04mol、n(H+)=0.14×2-0.08=0.2mol;
根据![]() ,0.04mol的Fe2+消耗氯气0.02mol,所以n=0.02;通入氯气后溶液中n(Fe3+)=0.1mol,根据
,0.04mol的Fe2+消耗氯气0.02mol,所以n=0.02;通入氯气后溶液中n(Fe3+)=0.1mol,根据![]() ,可知该反应消耗铁0.05mol,溶液中含有0.01mol铜离子,根据
,可知该反应消耗铁0.05mol,溶液中含有0.01mol铜离子,根据![]() ,可知消耗铁0.01mol,生成铜0.01mol;a溶液含有n(H+)=0.2mol,结合
,可知消耗铁0.01mol,生成铜0.01mol;a溶液含有n(H+)=0.2mol,结合![]() ,消耗铁0.1mol,生成氢气0.1mol。此时沉淀的质量=9-2.8-5.6-0.56+0.64=0.68g;故选C。
,消耗铁0.1mol,生成氢气0.1mol。此时沉淀的质量=9-2.8-5.6-0.56+0.64=0.68g;故选C。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】相关物质的溶度积常数见下表(25℃):
物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
Ksp(单位略) | 1.1×10—11 | 2.3×10﹣3 | 1.8×10﹣10 | 1.9×10﹣12 |
下列有关说法中不正确的是
A. 浓度均为0.2 molL﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B. 将0.001 molL﹣1的AgNO3溶液滴入0.001 molL﹣1的KCl和0.001 molL﹣1 的K2CrO4混合溶液中.先产生Ag2CrO4沉淀
C. 0.11 molL﹣1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D. 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
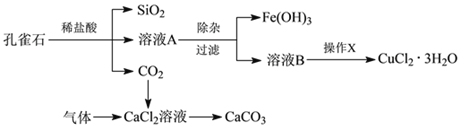
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
物质 | pH (开始沉淀) | pH(完全沉淀) |
Fe(OH)3 | 1.9 | 3.2 |
Fe(OH)2 | 7.0 | 9.0 |
Cu(OH)2 | 4.7 | 6.7 |
(1)在除杂过程时为了除去Fe2+,常加入绿色氧化剂,使Fe2+氧化为Fe3+,此过程涉及的离子方程式为________。
(2)然后再加入适当物质调节溶液的pH至_________ (填写范围),使Fe3+转化为Fe(OH)3,可以达到除去Fe3+,调整溶液pH不可选用下列中的________。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(3)检验Fe(OH)3是否沉淀完全的实验方案是________________________。
(4)操作X包括________、________、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是 ______________。
(5)某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.6g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①读数时,若滴定前平视,滴定后仰视,则所测CaCO3的质量分数将________(选填“偏大”、“偏小”或“无影响”)。
②若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为_______。