题目内容
6.氯气是一种重要的工业原料.工业上利用反应:3Cl2+2NH3→N2+6HCl 检查氯气管道是否漏气,有关说法中错误的是( )| A. | 该反应利用了Cl2的强氧化性 | B. | 若管道漏气遇氨就会产生白烟 | ||
| C. | 该反应属于复分解反应 | D. | 生成1molN2有6mol电子转移 |
分析 3Cl2+8NH3═N2+6NH4Cl,Cl元素的化合价降低,N元素的化合价升高,该反应转移6e-,以此来解答.
解答 解:A.N元素的化合价升高,则利用氨气的还原性,氯元素化合价降低,所以氯气是氧化剂,具有氧化性,故A正确;
B.反应生成氯化铵,观察到白烟可知管道漏气,故B正确;
C.反应中有单质参加和生成,不属于复分解反应,故C错误;
D.生成6mol NH4Cl有6mol×(1-0)=6mol电子转移,故D正确;
故选C.
点评 本题以氨气的性质考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应及转移电子的考查,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
16.为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于足量的稀盐酸,充分反应后,再进行下列实验,其结论正确的是( )
| A. | 若再滴加KSCN溶液,溶液未变红,说明铁粉未变质 | |
| B. | 若再依次滴加氯水、KSCN溶液,溶液变红,说明铁粉部分变质 | |
| C. | 若再滴加KSCN溶液,溶液变红,说明铁粉部分变质或全部变质 | |
| D. | 若再滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红,说明铁粉全部变质 |
17.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 过氧化氢的电子式: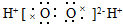 | ||
| C. | NH3的电子式: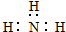 | D. | 乙酸的球棍模型: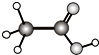 |
18.“绿色化学”是当今社会提出的一个新概念.在“绿色化学”工艺中,理想状态是反应物中原子全部转化为欲制的产物,即原子利用率为100%.以下反应最符合“绿色化学”原子经济性要求的是( )
| A. | 乙烯发生加聚反应制得聚乙烯高分子材料 | |
| B. | 用甲烷与氯气制备一氯甲烷 | |
| C. | 用苯和浓硫酸、浓硝酸为原料制取硝基苯 | |
| D. | 用石灰石和稀盐酸反应制得二氧化碳 |
15.下列关于电离度α的叙述中,正确的是( )
①α与浓度无关 ②α值随温度升高而增大 ③在相同条件下,α值的大小可以表示弱电解质的相对强弱 ④α值越大,相应离子浓度一定就越大 ⑤α值增大,相应离子的物质的量一定增大 ⑥在相同条件下,浓度相同的酸,α越大,其酸性也越强.
①α与浓度无关 ②α值随温度升高而增大 ③在相同条件下,α值的大小可以表示弱电解质的相对强弱 ④α值越大,相应离子浓度一定就越大 ⑤α值增大,相应离子的物质的量一定增大 ⑥在相同条件下,浓度相同的酸,α越大,其酸性也越强.
| A. | ①②③ | B. | ①④⑥ | C. | ②③⑥ | D. | ③④⑤ |
16.某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
(1)请完成以下实验设计表(表中不要留空格):
(2)编号①实验测得容器中压强随时间变化如图2甲.t2时,容器中压强明显小于起始压强,其原因是铁发生了吸氧腐蚀,请在图2乙中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了还原(填“氧化”或“还原”)反应,其电极反应式是O2+2H2O+4e-=4OH-.

(3)该小组对图2甲中0-t1时压强变大的原因提出了如下假设,请你完成假设二::
假设一:发生析氢腐蚀产生了气体;
假设二:反应放热使锥形瓶内温度升高;
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案,请你再设计一个实验方案验证假设一.
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 0.5 | 2.0 | 36.0 | |
| ③ | 碳粉质量的影响 | 0.2 | 90.0 |

(3)该小组对图2甲中0-t1时压强变大的原因提出了如下假设,请你完成假设二::
假设一:发生析氢腐蚀产生了气体;
假设二:反应放热使锥形瓶内温度升高;
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案,请你再设计一个实验方案验证假设一.

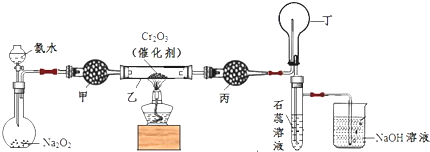
 请在该方程式中标明电子转移的方向和数目
请在该方程式中标明电子转移的方向和数目