题目内容
15.下列关于电离度α的叙述中,正确的是( )①α与浓度无关 ②α值随温度升高而增大 ③在相同条件下,α值的大小可以表示弱电解质的相对强弱 ④α值越大,相应离子浓度一定就越大 ⑤α值增大,相应离子的物质的量一定增大 ⑥在相同条件下,浓度相同的酸,α越大,其酸性也越强.
| A. | ①②③ | B. | ①④⑥ | C. | ②③⑥ | D. | ③④⑤ |
分析 ①电离度α与浓度有关,浓度越大,电离程度越小;
②弱电解质的电离为吸热反应,则升高温度,电离程度增大;
③在相同条件下,电离度越大,说明电离程度越强;
④α值越大,只能说明电离程度越强,电离出的离子的物质的量越大,但溶液中离子浓度不一定越大,因为离子浓度与溶质总浓度有关;
⑤α值增大,电离程度越大,弱电解质电离出的离子的物质的量越大,必须指明相应离子;
⑥在相同条件下,浓度相同的酸,α越大,电离程度越强,则其酸性也越强.
解答 解:①电离度α与电解质的浓度有关,浓度越大,电离程度越小,浓度越小,电离程度则越大,故①错误;
②弱电解质的电离过程为吸热反应,升高温度,电离程度增大,则电离度增大,故②正确;
③在相同条件下,电离度大小说明了弱电解质的电离程度强弱,则α值的大小可以表示弱电解质的相对强弱,故③正确;
④α值越大,只能说明电离程度越强,电离出的离子的物质的量越大,由于离子浓度与溶质总浓度有关,则溶液中离子浓度不一定越大,故④错误;
⑤电离度α值增大,弱电解质的电离程度增大,则电解质电离出的离子的物质的量也一定增大,但是溶液中其它离子浓度不一定增大,如:亚硫酸氢钠溶液,高温度后亚硫酸氢根离子电离程度增大,溶液中氢离子、亚硫酸根离子物质的量增大,但是溶液中亚硫酸氢根离子的物质的量减小,故⑤正确;
⑥在相同条件下,浓度相同的酸,电离度α越大,酸的电离程度越强,氢离子浓度越大,则其酸性也越强,故⑥正确;
故选C.
点评 本题考查了弱电解质的电离度及其判断,题目难度中等,明确电离度的概念及影响因素为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
6.氯气是一种重要的工业原料.工业上利用反应:3Cl2+2NH3→N2+6HCl 检查氯气管道是否漏气,有关说法中错误的是( )
| A. | 该反应利用了Cl2的强氧化性 | B. | 若管道漏气遇氨就会产生白烟 | ||
| C. | 该反应属于复分解反应 | D. | 生成1molN2有6mol电子转移 |
3.化学与生活密切相关,下列有关说法错误的是( )
| A. | 在人体内,油脂的主要反应是在脂肪酶催化下水解为高级脂肪酸和甘油 | |
| B. | 鉴别蚕丝和人造丝(纤维素)的方法之一是灼烧,有烧焦羽毛气味的是蚕丝 | |
| C. | 农村兴建沼气池将秸秆发酵产生沼气,可减少因焚烧带来的环境污染 | |
| D. | 氮、磷是作物生长的重要元素,故含氮、磷的废水可直接排放到湖泊中 |
20.在溶液中进行的化学反应Ag++Fe2+?Ag(s)+Fe3+ (正反应放热),为使平衡体系析出更多的银,可采取的措施是( )
| A. | 移去一些析出的银 | B. | 增加Fe2+的浓度 | ||
| C. | 升高溶液的温度 | D. | 常温下加压 |
7.如图为元素周期表短周期的一部分.有关A、B、C、D四种元素的叙述中,错误的是( )
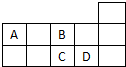

| A. | A和B可形成AB32-、A2B42-等离子 | |
| B. | B的氢化物的沸点低于C的氢化物的沸点 | |
| C. | 单质C的晶体中含有共价键和范德华力 | |
| D. | 由A、D形成的一种物质可用以提取碘水中碘单质 |
4.在Na2C2O4溶液中,存在多种分子和离子,下列关系中不正确的是( )
| A. | c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| B. | c(Na+)=2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-) | |
| C. | c(OH-)-c(HC2O4-)=c(H+)+2c(H2C2O4) | |
| D. | c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) |
5.下列推断正确的是( )
| A. | SO2、SO3组成元素相同,与H2O反应产物也相同 | |
| B. | 浓硝酸见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| C. | CO、NO、NO2都能形成光化学烟雾,是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
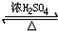 HCO18OCH3+H2O.
HCO18OCH3+H2O.