题目内容
11.经过科学家的大量研究,工业上氮气和氢气在一定条件下直接化合制得氨.图1是工业合成氨生产的示意图.①图1中分离出物质X的化学式为NH3.
②图1中选定500℃、20~50MPa条件的主要原因BC(填字母)
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大

C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动.图2表示随条件改变,氨气的百分含量的变化趋势.
当横坐标为压强时,变化趋势正确的是(选填a、b、c)c;
当横坐标为温度时,变化趋势正确的是(选填a、b、c)a.
④常温下氨气极易溶于水,其水溶液可以导电,请用方程式表示氨气溶于水过程中存在的可逆反应NH3+H2O?NH3•H2O?NH4++OH-.
分析 ①根据题干中的流程图1生产流程知,原料气氮气和氢气,经过氨的合成、氨的分离,循环利用的为氮气和氢气的混合气,分离出的是氨气,据此解答;
②该反应为可逆反应,根据化学平衡移动原理及其生产实际进行解答;
③合成氨反应是一个体积减小反应,可以得出随着压强的增大,平衡向氨气增大的方向移动,结合图象可以知道c符合要求.又因为合成氨反应是一个放热反应,可以得出随着温度的升高,平衡向氨气减少的方向移动,结合图象可以知道a符合要求;
④氨气和水反应生成氨水,氨水电离生成氢氧根离子和铵根离子,据此解答;
解答 解:①合成氨工业有下列流程:原料气制备、原料气净化和压缩、氨的合成、氨的分离,从图1生产流程知,原料气氮气和氢气,经过氨的合成、氨的分离,所以X为氨气,Y为氮气和氢气的混合气,再循环利用,故答案为:NH3;
②A.升高温度,能使反应速率加快,但该反应正反应为放热反应,升高温度,平衡向逆反应方向移动,不利于氨的合成;增大压强,能使反应速率加快,反应也向正反应方向移动,但过高的压强,反应成本高,故A错误;
B.实际生产中采用400~500℃的高温,催化剂的催化活性最高,可以增加反应速率,缩短达到平衡的时间;故B正确;
C.合成氨工业的原理是:N2+3H2$?_{500℃、铁触煤}^{20-50MPa}$2NH3△H<0,从化学平衡的角度看,温度越低,压强越大,越有利于合成氨,工业生产以经济利益最大化为目的,所以工业生产受动力、材料、设备等条件的限制,目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa,故C正确;
故答案为:BC.
③合成氨工业的原理是:N2+3H2$?_{500℃、铁触煤}^{20-50MPa}$2NH3△H<0,因△H<0,从化学平衡的角度看,正反应为放热反应,温度越低,越有利于合成氨,增加温度,平衡向逆反应方向移动,氨气的百分含量减少;正反应为体积缩小的反应,所以压强越大,越有利于合成氨,增大压强时平衡向右进行,氨气的百分含量增大,结合图象可以知道c符合要求.又因为合成氨反应是一个放热反应,可以得出随着温度的升高,平衡向氨气减少的方向移动,结合图象可以知道a符合要求;答案为:c;a;
④氨气和水反应生成氨水,氨水电离生成氢氧根离子和铵根离子,方程式为:NH3+H2O?NH3•H2O?NH4++OH-,
故答案为:NH3+H2O?NH3•H2O?NH4++OH-;
点评 本题主要考查了合成氨工业,题目综合性强,难度较大,掌握合成氨工业的流程,掌握化学反应速率、化学平衡的移动以及热化学部分的知识,是解答本题的关键.

①取代反应②消去反应③加成反应④酯化反应⑤缩聚反应⑥加聚反应.
| A. | ②⑤ | B. | ①④ | C. | ③⑥ | D. | ⑤⑥ |
| A. | 该反应利用了Cl2的强氧化性 | B. | 若管道漏气遇氨就会产生白烟 | ||
| C. | 该反应属于复分解反应 | D. | 生成1molN2有6mol电子转移 |
| A. | 苯的硝化反应是取代反应 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色 | |
| C. | 78g苯(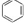 )中含有C=C双键的数目为3NA )中含有C=C双键的数目为3NA | |
| D. | 在一定条件下,苯能与氢气发生加成反应 |
| A. | 在人体内,油脂的主要反应是在脂肪酶催化下水解为高级脂肪酸和甘油 | |
| B. | 鉴别蚕丝和人造丝(纤维素)的方法之一是灼烧,有烧焦羽毛气味的是蚕丝 | |
| C. | 农村兴建沼气池将秸秆发酵产生沼气,可减少因焚烧带来的环境污染 | |
| D. | 氮、磷是作物生长的重要元素,故含氮、磷的废水可直接排放到湖泊中 |
| A. | 移去一些析出的银 | B. | 增加Fe2+的浓度 | ||
| C. | 升高溶液的温度 | D. | 常温下加压 |
| A. | 水、双氧水、水玻璃都是纯净物 | B. | 乙醚和乙醇互为同分异构体 | ||
| C. | 乙醇、氯气、葡萄糖都是非电解质 | D. | 甲酸与硬脂酸属于同系物 |
 .
.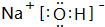 或
或 等,一种共价化合物的电子式为
等,一种共价化合物的电子式为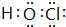 等.
等.