题目内容
【题目】硫代硫酸钠晶体(Na2S2O35H2O)俗称海波或大苏打,是一种重要的工业试剂。
(1)硫代硫酸钠加热至310℃分解,生成硫和亚硫酸钠,写出反应的化学方程式_______,该反应为吸热反应,说明断裂反应物化学键时所吸收的总能量_____形成生成物化学键时所放出的总能量(填 “大于”、“等于”或 “小于”)。硫代硫酸钠在酸性条件下发生如下反应Na2S2O3+H2SO4=Na2SO4+H2O+SO2↑+S↓,每生成4g S转移的电子数为________。
(2)向热的硫化钠和亚硫酸钠混合液中通入二氧化硫,可制得硫代硫酸钠晶体:2Na2S+Na2SO3+3SO2+5H2O![]() 3Na2S2O35H2O。
3Na2S2O35H2O。
①下列能判断制取硫代硫酸钠的反应达到平衡状态的是_________
A.Na2S和Na2SO3的浓度不再发生变化
B.在单位时间内生成0.03mol Na2S2O35H2O,同时消耗了0.02molNa2S
C.v(Na2S): v (Na2SO3) =2:1
②制备过程中,为提高硫代硫酸钠的产量,通入的SO2不能过量,原因是_____。
(3)某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表:
组号 | 反应温度(℃) | 参加反应的物质 | ||||
Na2S2O3 | H2SO4 | H2O | ||||
V/mL | c/molL-1 | V/mL | c/molL-1 | V/mL | ||
A | 10 | 10 | 0.1 | 10 | 0.1 | 0 |
B | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
C | 10 | 5 | 0.2 | 10 | 0.2 | 5 |
D | 30 | 5 | 0.1 | 10 | 0.1 | 5 |
①上述实验中能够说明反应物浓度对反应速率影响的组合是___________。
②能够说明温度对反应速率影响的组合是_______。
(4)某些多硫化钠可用于制作原电池(如图所示),该电池的工作原理是:2Na2S2+NaBr3=Na2S4+3NaBr
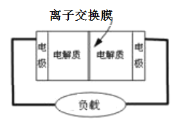
①电池中左侧的电极反应式为Br3- + 2e-= 3Br-,则左侧电极名称是_____________(填“正极”或“负极”)。
②原电池工作过程中钠离子__________(选“从左到右”或“从右到左”)通过离子交换膜。
③原电池工作过程中生成的氧化产物是___________(填化学式)。
【答案】Na2S2O3![]() S+Na2SO3 大于 1.505×1023(或0.25NA) A SO2过量,溶液显酸性,Na2S2O3遇酸易反应 A、B(或A、C或B、C) B、D 正极 从右到左 Na2S4
S+Na2SO3 大于 1.505×1023(或0.25NA) A SO2过量,溶液显酸性,Na2S2O3遇酸易反应 A、B(或A、C或B、C) B、D 正极 从右到左 Na2S4
【解析】
(1)硫代硫酸钠加热至310℃分解,生成硫和亚硫酸钠,根据氧化还原反应可写出反应的化学方程式为Na2S2O3![]() S+Na2SO3;该反应为吸热反应,反应物的总键能比生成物的总键能高,则断裂反应物化学键时所吸收的总能量大于形成生成物化学键时所放出的总能量;根据反应方程式Na2S2O3+H2SO4=Na2SO4+H2O+SO2↑+S↓可知,每生成1molS转移的电子数为2NA,则每生成4g S转移的电子数为1.505×1023(或0.25NA),故答案为:Na2S2O3
S+Na2SO3;该反应为吸热反应,反应物的总键能比生成物的总键能高,则断裂反应物化学键时所吸收的总能量大于形成生成物化学键时所放出的总能量;根据反应方程式Na2S2O3+H2SO4=Na2SO4+H2O+SO2↑+S↓可知,每生成1molS转移的电子数为2NA,则每生成4g S转移的电子数为1.505×1023(或0.25NA),故答案为:Na2S2O3![]() S+Na2SO3;大于;1.505×1023(或0.25NA);
S+Na2SO3;大于;1.505×1023(或0.25NA);
(2)①A.Na2S和Na2SO3的浓度不再发生变化,说明正逆反应速率相等,反应达到化学平衡状态,故A正确;
B.在单位时间内生成0.03mol Na2S2O35H2O,为正反应速率,同时消耗了0.02molNa2S,也为正反应速率,不能说明该反应达到化学平衡状态,故B错误;
C.无论反应是否达到化学平衡状态,均有v(Na2S):v(Na2SO3) =2:1,则不能用v(Na2S):v(Na2SO3) =2:1来判断反应是否达到化学平衡状态,故C错误;
综上所述,答案为:A;
②制备过程中,若通入的SO2过量,则溶液显酸性,Na2S2O3遇酸易反应,会使硫代硫酸钠的产量降低,故答案为:SO2过量,溶液显酸性,Na2S2O3遇酸易反应;
(3)①若说明反应物浓度对反应速率影响,则应只改变浓度因素,其他条件相同,所以A、B(或A、C或B、C)实验均可以,故答案为:A、B(或A、C或B、C);
②若说明温度对反应速率影响,则只改变温度因素,浓度因素等其他因素要相同,则B、D实验可以对比得出结论,故答案为:B、D;
(4)①电池中左侧电极反应得到电子,则左侧电极为正极,故答案为:正极;
②该装置中,左侧为正极,右侧为负极,钠离子为阳离子,根据原电池原理,阳离子移向正极,则原电池工作过程中钠离子从右到左通过离子交换膜,故答案为:从右到左;
③氧化产物是还原剂发生氧化反应得到的,则是负极Na2S2被氧化生成的Na2S4,故答案为:Na2S4。

【题目】在一定温度下,将气体0.22 mol X和气体0.16 mol Y充入5 L恒容密闭容器中,发生反应2X(g) + Y(g) ![]() 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A. 该温度下此反应的平衡常数K = 72.0 L/mol
B. 反应前2 min的平均速率υ(Z) = 4.0×10-3 mol/(L·min)
C. 其他条件不变,降低温度,反应达到新平衡前υ(逆) > υ(正)
D. 其他条件不变,再充入0.1 mo1 X,新平衡时X的转化率将增大