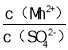题目内容
【题目】部分短周期元素原子半径与原子序数的关系如图所示.则下列说法正确的是( )
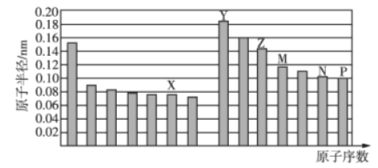
A.简单离子半径: Z>N
B.简单氢化物的稳定性: P > X
C.由 X 与 M 两种元素组成的化合物不能与任何酸 反应,但能与强碱反应
D.Z 的氧化物能溶解于 Y 的最高价氧化物对应水化 物的水溶液中,也能溶解于 P 的氢化物的水溶液中
【答案】D
【解析】
同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可以知道X 为氧元素,Y 为Na 元素,Z 为Al 元素,M 为Si 元素,N为S元素,P为Cl元素。
A. Z的简单离子![]() 有两个电子层,N的简单离子
有两个电子层,N的简单离子![]() 有三个电子层,所以Z的简单离子半径小于N,A错误;
有三个电子层,所以Z的简单离子半径小于N,A错误;
B. O的非金属性强于Cl,所以简单氢化物的稳定性P<X,B错误;
C. X与M组成的化合物为![]() ,由于Si元素的亲氟性,导致其可以与氢氟酸发生反应,C错误;
,由于Si元素的亲氟性,导致其可以与氢氟酸发生反应,C错误;
D. Z的氧化物![]() 为两性氧化物,可以溶于强酸HCl溶液中,也可以溶于强碱NaOH溶液中,D正确;
为两性氧化物,可以溶于强酸HCl溶液中,也可以溶于强碱NaOH溶液中,D正确;
故答案选D。

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)
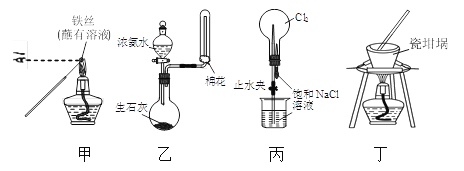
A. 用装置甲检验溶液中是否有K+
B. 用装置乙制取并收集少量NH3
C. 用装置丙进行喷泉实验
D. 用装置丁加热熔融NaOH固体
【题目】硫代硫酸钠晶体(Na2S2O35H2O)俗称海波或大苏打,是一种重要的工业试剂。
(1)硫代硫酸钠加热至310℃分解,生成硫和亚硫酸钠,写出反应的化学方程式_______,该反应为吸热反应,说明断裂反应物化学键时所吸收的总能量_____形成生成物化学键时所放出的总能量(填 “大于”、“等于”或 “小于”)。硫代硫酸钠在酸性条件下发生如下反应Na2S2O3+H2SO4=Na2SO4+H2O+SO2↑+S↓,每生成4g S转移的电子数为________。
(2)向热的硫化钠和亚硫酸钠混合液中通入二氧化硫,可制得硫代硫酸钠晶体:2Na2S+Na2SO3+3SO2+5H2O![]() 3Na2S2O35H2O。
3Na2S2O35H2O。
①下列能判断制取硫代硫酸钠的反应达到平衡状态的是_________
A.Na2S和Na2SO3的浓度不再发生变化
B.在单位时间内生成0.03mol Na2S2O35H2O,同时消耗了0.02molNa2S
C.v(Na2S): v (Na2SO3) =2:1
②制备过程中,为提高硫代硫酸钠的产量,通入的SO2不能过量,原因是_____。
(3)某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表:
组号 | 反应温度(℃) | 参加反应的物质 | ||||
Na2S2O3 | H2SO4 | H2O | ||||
V/mL | c/molL-1 | V/mL | c/molL-1 | V/mL | ||
A | 10 | 10 | 0.1 | 10 | 0.1 | 0 |
B | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
C | 10 | 5 | 0.2 | 10 | 0.2 | 5 |
D | 30 | 5 | 0.1 | 10 | 0.1 | 5 |
①上述实验中能够说明反应物浓度对反应速率影响的组合是___________。
②能够说明温度对反应速率影响的组合是_______。
(4)某些多硫化钠可用于制作原电池(如图所示),该电池的工作原理是:2Na2S2+NaBr3=Na2S4+3NaBr

①电池中左侧的电极反应式为Br3- + 2e-= 3Br-,则左侧电极名称是_____________(填“正极”或“负极”)。
②原电池工作过程中钠离子__________(选“从左到右”或“从右到左”)通过离子交换膜。
③原电池工作过程中生成的氧化产物是___________(填化学式)。