题目内容
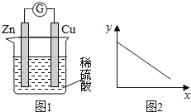
【题目】某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2 mol电子时停止电解,析出Na2SO4·10H2O晶体m g,所有数据都在相同温度下测得,下列叙述不正确的是
A. 电解后溶液质量减少(m+18)g
B. 原溶液中Na2SO4的质量分数为![]()
C. 若其他条件不变,将石墨替换为铜电极,则阴极析出1mol H2
D. 若其他条件不变,将石墨替换为铜电极,则析出Na2SO4·10H2O晶体仍为m g
【答案】D
【解析】本题考查的是电解原理,饱和溶液有关计算等知识点,为高频考点。侧重考查学生分析能力和计算能力,明确饱和溶液的特点,电解时阳极上铜失去电子而不是溶液中的阴离子失去电子是易错点。
A.电解后溶液质量减少量=电解水的质量+析出晶体的质量=(18+m)g,故正确;B.析出硫酸钠的质量为![]() =71/161mg,溶液质量=(18+m)g,溶液质量分数=溶质质量/溶液质量=
=71/161mg,溶液质量=(18+m)g,溶液质量分数=溶质质量/溶液质量= 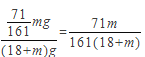 ,故正确;C. 若气体条件不变,将石墨电极替换为铜电极,阴极上仍然是氢离子放电生成氢气,但是阳极上铜失去电子生成铜离子,阴极上析出1mol氢气,故错误;D若其它条件不变,将石墨电极替换为铜电极,阳极上生成铜离子,阴极上生成氢气同时还有氢氧根离子生成,铜离子和氢氧根离子反应生成氢氧化铜沉淀,其电池反应为Cu+2H2O
,故正确;C. 若气体条件不变,将石墨电极替换为铜电极,阴极上仍然是氢离子放电生成氢气,但是阳极上铜失去电子生成铜离子,阴极上析出1mol氢气,故错误;D若其它条件不变,将石墨电极替换为铜电极,阳极上生成铜离子,阴极上生成氢气同时还有氢氧根离子生成,铜离子和氢氧根离子反应生成氢氧化铜沉淀,其电池反应为Cu+2H2O![]() Cu(OH)2+H2↑,根据方程式可知,转移2mol电子,消耗2mol水,则析出Na2SO4·10H2O晶体为2mg,故错误。故选D。
Cu(OH)2+H2↑,根据方程式可知,转移2mol电子,消耗2mol水,则析出Na2SO4·10H2O晶体为2mg,故错误。故选D。

 阅读快车系列答案
阅读快车系列答案【题目】硫代硫酸钠晶体(Na2S2O35H2O)俗称海波或大苏打,是一种重要的工业试剂。
(1)硫代硫酸钠加热至310℃分解,生成硫和亚硫酸钠,写出反应的化学方程式_______,该反应为吸热反应,说明断裂反应物化学键时所吸收的总能量_____形成生成物化学键时所放出的总能量(填 “大于”、“等于”或 “小于”)。硫代硫酸钠在酸性条件下发生如下反应Na2S2O3+H2SO4=Na2SO4+H2O+SO2↑+S↓,每生成4g S转移的电子数为________。
(2)向热的硫化钠和亚硫酸钠混合液中通入二氧化硫,可制得硫代硫酸钠晶体:2Na2S+Na2SO3+3SO2+5H2O![]() 3Na2S2O35H2O。
3Na2S2O35H2O。
①下列能判断制取硫代硫酸钠的反应达到平衡状态的是_________
A.Na2S和Na2SO3的浓度不再发生变化
B.在单位时间内生成0.03mol Na2S2O35H2O,同时消耗了0.02molNa2S
C.v(Na2S): v (Na2SO3) =2:1
②制备过程中,为提高硫代硫酸钠的产量,通入的SO2不能过量,原因是_____。
(3)某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表:
组号 | 反应温度(℃) | 参加反应的物质 | ||||
Na2S2O3 | H2SO4 | H2O | ||||
V/mL | c/molL-1 | V/mL | c/molL-1 | V/mL | ||
A | 10 | 10 | 0.1 | 10 | 0.1 | 0 |
B | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
C | 10 | 5 | 0.2 | 10 | 0.2 | 5 |
D | 30 | 5 | 0.1 | 10 | 0.1 | 5 |
①上述实验中能够说明反应物浓度对反应速率影响的组合是___________。
②能够说明温度对反应速率影响的组合是_______。
(4)某些多硫化钠可用于制作原电池(如图所示),该电池的工作原理是:2Na2S2+NaBr3=Na2S4+3NaBr
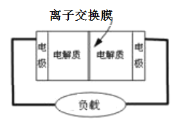
①电池中左侧的电极反应式为Br3- + 2e-= 3Br-,则左侧电极名称是_____________(填“正极”或“负极”)。
②原电池工作过程中钠离子__________(选“从左到右”或“从右到左”)通过离子交换膜。
③原电池工作过程中生成的氧化产物是___________(填化学式)。