题目内容
【题目】二氧化碳的捕集与利用是实现温室气体减排的重要途径之一。
(1)目前工业上使用的捕碳剂有 NH3 和(NH4)2CO3,它们与 CO2 可发生如下可逆反应:
2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) K1
(NH4)2CO3(aq) K1
NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) K2
NH4HCO3(aq) K2
(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) K3
2NH4HCO3(aq) K3
则 K3=________(用含 K1、K2 的代数式表示)。
(2)利用 CO2 制备乙烯是我国能源领域的一个重要战略方向,具体如下:
方法一:
CO2 催化加氢合成乙烯,其反应为:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:
C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:

①a______0(选填“>”或“<”)。
②下列说法正确的是______(填字母序号)。
A 、使用催化剂,可降低反应活化能,加快反应速率
B 、其它条件不变时,若扩大容器容积,则 v正减小,v逆增大
C 、测得容器内混合气体密度不随时间改变时,说明反应已达平衡
③393 K下,H2的平衡转化率为________(保留三位有效数字)。
④393 K下,该反应达到平衡后,再向容器中按 n(CO2)∶n(H2)=1∶3 投入 CO2 和 H2 ,则n(H2)/n(C2H4)将____(填“变大”、“不变”或“变小”)。
方法二:
用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图乙所示。
⑤b电极上的电极反应式为_______。
⑥该装置中使用的是__________(填“阴”或“阳”)离子交换膜。
【答案】![]() < A 67.4% 变小 2CO2+12H++12e-=C2H4+4H2O 阳
< A 67.4% 变小 2CO2+12H++12e-=C2H4+4H2O 阳
【解析】
(1)① 2NH3(l)+H2O(l)+CO2(g)═(NH4)2CO3(aq) K1
② NH3(l)+H2O(l)+CO2(g)═NH4HCO3(aq) K2
根据盖斯定律②×2-①可得:(NH4)2CO3(aq)+H2O (l)+CO2(g)2NH4HCO3(aq),因此 K3=![]() ;
;
(2)①由图甲可知,升高温度,氢气的物质的量增多,平衡逆向移动,则正反应为放热反应,a<0;
②A.使用催化剂,可降低反应活化能,加快反应速率,选项A正确;
B.其它条件不变时,若扩大容器容积,则v正减小,v逆减小,选项B错误;
C.反应前后气体质量不变,恒容条件下密度始终不变,密度不变不能说明反应已达到平衡,选项C错误;
D.反应使用合适的催化剂,催化剂改变反应历程加快反应速率,不改变化学平衡,不改变反应焓变,选项D错误;
答案选A;
③图象分析可知,393K时平衡状态下水、H2的物质的量分别为58mol、42mol,生成58molH2O必然消耗87molH2,则初始时H2的物质的量为(87+42)mol=129mol,则H2的转化率为![]() ×100%=67.4%;
×100%=67.4%;
④393K下,该反应达到平衡后,再向容器中按n(CO2):n(H2)=1:3投入CO2和H2,相当于增大压强,平衡正向移动,所以则n(H2)/n(C2H4)将变小;
⑤电解时,二氧化碳在b极上得电子发生还原反应生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O;
⑥离子交换只允许氢离子通过,所以是阳离子交换膜。

【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A. 使用催化剂 B. 适当提高氧气的浓度
C. 适当提高反应的温度 D. 适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。
(资料)①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
化学键 | H—H | O=O | H—O |
键能 | 436 | 496 | 463 |
请填写表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化 | |
拆开化学键 |
| ______ | ____ |
| ______ | ____ | |
形成化学键 |
| ______ | ____ |
总能量变化 | ______ | ____ | |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是__________________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是__________________L。
【题目】硫代硫酸钠晶体(Na2S2O35H2O)俗称海波或大苏打,是一种重要的工业试剂。
(1)硫代硫酸钠加热至310℃分解,生成硫和亚硫酸钠,写出反应的化学方程式_______,该反应为吸热反应,说明断裂反应物化学键时所吸收的总能量_____形成生成物化学键时所放出的总能量(填 “大于”、“等于”或 “小于”)。硫代硫酸钠在酸性条件下发生如下反应Na2S2O3+H2SO4=Na2SO4+H2O+SO2↑+S↓,每生成4g S转移的电子数为________。
(2)向热的硫化钠和亚硫酸钠混合液中通入二氧化硫,可制得硫代硫酸钠晶体:2Na2S+Na2SO3+3SO2+5H2O![]() 3Na2S2O35H2O。
3Na2S2O35H2O。
①下列能判断制取硫代硫酸钠的反应达到平衡状态的是_________
A.Na2S和Na2SO3的浓度不再发生变化
B.在单位时间内生成0.03mol Na2S2O35H2O,同时消耗了0.02molNa2S
C.v(Na2S): v (Na2SO3) =2:1
②制备过程中,为提高硫代硫酸钠的产量,通入的SO2不能过量,原因是_____。
(3)某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如下表:
组号 | 反应温度(℃) | 参加反应的物质 | ||||
Na2S2O3 | H2SO4 | H2O | ||||
V/mL | c/molL-1 | V/mL | c/molL-1 | V/mL | ||
A | 10 | 10 | 0.1 | 10 | 0.1 | 0 |
B | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
C | 10 | 5 | 0.2 | 10 | 0.2 | 5 |
D | 30 | 5 | 0.1 | 10 | 0.1 | 5 |
①上述实验中能够说明反应物浓度对反应速率影响的组合是___________。
②能够说明温度对反应速率影响的组合是_______。
(4)某些多硫化钠可用于制作原电池(如图所示),该电池的工作原理是:2Na2S2+NaBr3=Na2S4+3NaBr
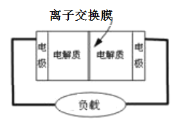
①电池中左侧的电极反应式为Br3- + 2e-= 3Br-,则左侧电极名称是_____________(填“正极”或“负极”)。
②原电池工作过程中钠离子__________(选“从左到右”或“从右到左”)通过离子交换膜。
③原电池工作过程中生成的氧化产物是___________(填化学式)。