题目内容
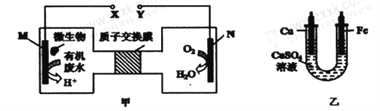
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
【答案】C
【解析】A. Ksp(CuCl)只与温度有关,与溶液pH无关,故A错误;B. 根据图像,溶液的pH越小,溶液中残留c(Cl—)越大,因此向电解液中加入稀硫酸,不利于Cl-的去除,故B错误;C. 根据Cu(s)+Cu2+(aq)![]() 2Cu+(aq),增大c(Cu2+),平衡正向移动,使得c(Cu+)增大,促进Cl—(aq)+Cu+(aq)
2Cu+(aq),增大c(Cu2+),平衡正向移动,使得c(Cu+)增大,促进Cl—(aq)+Cu+(aq)![]() CuCl(s)右移,c(Cl—)减小,故C正确;D.①Cu(s)+Cu2+(aq)
CuCl(s)右移,c(Cl—)减小,故C正确;D.①Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1,②Cl—(aq)+Cu+(aq)
2Cu+(aq) ΔH1=a kJ·mol-1,②Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1,根据盖斯定律,将①×
CuCl(s) ΔH2=b kJ·mol-1,根据盖斯定律,将①×![]() +②得:
+②得: ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(
CuCl(s)的ΔH=(![]() +b) kJ·mol-1,故D错误;故选C。
+b) kJ·mol-1,故D错误;故选C。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目