题目内容
18.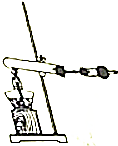 氮元素是地球上含量很丰富的一种元素,其单质和化合物对我们的环境和生命有重要的意义.
氮元素是地球上含量很丰富的一种元素,其单质和化合物对我们的环境和生命有重要的意义.(1)NH3是重要的化工原料,工业上制取NH3的化学方程式是N2+3H2$?_{催化剂}^{高温高压}$2NH3;
(2)实验室中用如图所示装置制取纯净干燥的氨气,试管中是一种固体,干燥管中是碱石灰,则试管中的固体可以是BD.
A、NH4Cl
B、NH4HCO3
C、Ca(OH)2和(NH4)2SO4
D、(NH4)2CO3.
分析 (1)工业用氮气与氢气在催化剂条件下反应制备氨气;
(2)图中装置制取气体的特点为:固体与液体加热;碳酸铵、碳酸氢铵分解生成二氧化碳和水,碱石灰能够吸收水和二氧化碳,据此解答.
解答 (1)工业用氮气与氢气在催化剂条件下反应制备氨气,方程式:N2+3H2$?_{催化剂}^{高温高压}$2NH3;
故答案为:N2+3H2$?_{催化剂}^{高温高压}$2NH3;
(2)A.氯化铵受热分解生成氨气与氯化氢,但是二者受冷有重新生成氯化铵,故A不选;
B.碳酸氢铵分解生成氨气、二氧化碳和水,二氧化碳和水能够被碱石灰吸收,所以可以制取氨气,故B选;
C.氢氧化钙与硫酸铵反应生成硫酸钙和氨气,硫酸钙微溶,阻止反应,故C不选;
D.碳酸铵受热分解生成氨气、水和二氧化碳,二氧化碳和水能够被碱石灰吸收,所以可以制取氨气,故D选;
故选:BD.
点评 本题考查了氨气的制备,明确工业制备氨气、实验室制备氨气的原理是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.能源可划分为一级能源和二级能源.自然界中以形成形式提供的能源称为一级能源,需依靠其他能源间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:2H2O(l)═2H2(g)+O2(g)下列叙述正确的是( )
| A. | 电源是一级能源 | B. | 天然气是一级能源 | ||
| C. | 水力是二级能源 | D. | 干馏煤气是一级能源 |
9.下列说法错误的是( )
| A. | 氧化铝陶瓷、氮化硅陶瓷都属于新型无机非金属材料 | |
| B. | 煤矿井下的瓦斯爆炸主要是氢气燃烧引起的 | |
| C. | 乙烯的产量是衡量一个国家石油化工发展水平的标志 | |
| D. | 在粉尘较多的工作场所,工作人员易患硅肺病 |
6.已知,常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,下列叙述中正确的是( )
| A. | 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 | |
| B. | 向AgCl的饱和溶液中加入KCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) | |
| C. | 常温下,AgCl在饱和KCl溶液中的Ksp比在纯水中的Ksp小 | |
| D. | 将0.001 mol•L-1的AgNO3溶液滴入NaCl和NaI的混合溶液中,一定先产生AgI沉淀 |
13.下列反应的离子方程式正确的是( )
| A. | 向氨水中滴入稀硫酸:H++OH-═H2O | |
| B. | 向硫酸铝溶液中滴入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向饱和氨水中通过量的CO2气体:NH3+H2O+CO2═NH4++HCO3- | |
| D. | 向氯化铵的稀溶液中滴入少量的NaOH溶液:NH4++OH-═NH3•H2O |
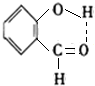
3.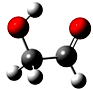 迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )
迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )
 迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )
迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )| A. | 有2种含氧官能团 | B. | 能发生银镜反应 | ||
| C. | 与葡萄糖互为同系物 | D. | 与乙酸互为同分异构体 |
7.欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的是( )
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3 溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 乙酸(乙醇):加入金属钠,蒸馏 | |
| D. | 苯(液溴):加入NaOH溶液,分液 |

 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: .
. .
.