题目内容
12.下列化学用语正确的是( )| A. | Na+的电子排布图: | |
| B. | HF的电子式: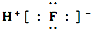 | |
| C. | Fe2+的核外电子排布式:1s22s22p63s23p63d6 | |
| D. | N2的结构简式::N≡N: |
分析 A.钠离子核外有10个电子,且同一轨道中电子的自旋方向应该相反;
B.氟化氢为共价化合物,不存在阴阳离子;
C.铁原子失去2个电子变成亚铁离子,Fe2+的最外层含有22;
D.氮气分子中氮氮原子间存在共价三键.
解答 解:A.钠离子核外有10个电子,同一轨道中电子自旋方向相反,钠离子的基态电子排布图为: ,故A错误;
,故A错误;
B.氟化氢属于共价化合物,不能标出电荷,氟化氢正确的电子式为: ,故B错误;
,故B错误;
C.铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时,核外电子排布式为:1s22s22p63s23p63d6或[Ar]3d6,故C正确;
D.氮气分子中氮氮原子间存在共价三键,其结构简式为N≡N,故D错误;
故选C.
点评 本题考查了化学用语的表示方法判断,题目难度中等,涉及电子排布式、电子式、轨道表示式的综合应用,注意掌握常见化学用语的书写原则,试题培养了学生的化学计算能力和规范答题的能力.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃的条件下△H应该不相同 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 任何放热反应在常温下一定能发生 | |
| D. | 反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
20.下列说法正确的是( )
| A. | 7.8 g Na2O2中含有的阴离子数为0.1NA | |
| B. | 常温下,含0.1 mol碳酸钠的溶液中含有CO${\;}_{3}^{2-}$的个数为0.1NA | |
| C. | 7.8 g Na2S和Na2O2的混合物中,含有的阳离子数目为0.1NA | |
| D. | 12 g NaHSO4晶体中阳离子和阴离子的总数为0.3NA |
7.下列有机化合物的性质能体现是羟基对苯环产生影响的是( )
| A. | 苯酚溶液显弱酸性 | |
| B. | 苯酚和乙醇中,分别加入金属钠,苯酚反应剧烈 | |
| C. | 苯酚比苯容易发生溴代反应 | |
| D. | 苯酚能与氢氧化钠溶液反应,而苯甲醇不能 |
8.有一类有机硅化合物中只含有硅元素和氢元素,叫硅烷,它们的分子组成与烷烃相似,其中有一种结构最简单的硅烷叫甲硅烷(SiH4),则有关描述不正确的是( )
| A. | 硅烷的分子通式可表示为SinH2n+2 | B. | 甲硅烷燃烧生成SiO2和H2O | ||
| C. | 甲硅烷的沸点高于甲烷 | D. | 甲硅烷的稳定性比甲烷强 |
 反应生成的化合物的结构简式.
反应生成的化合物的结构简式.