题目内容
20.下列说法正确的是( )| A. | 7.8 g Na2O2中含有的阴离子数为0.1NA | |
| B. | 常温下,含0.1 mol碳酸钠的溶液中含有CO${\;}_{3}^{2-}$的个数为0.1NA | |
| C. | 7.8 g Na2S和Na2O2的混合物中,含有的阳离子数目为0.1NA | |
| D. | 12 g NaHSO4晶体中阳离子和阴离子的总数为0.3NA |
分析 A、求出过氧化钠的物质的量,然后根据过氧化钠由2个钠离子和1个过氧根构成来分析;
B、碳酸根为弱酸根,在溶液中会水解;
C、Na2S和Na2O2的摩尔质量均为78g/mol,且均含2个阳离子;
D、NaHSO4晶体由一个钠离子和一个硫氢根离子构成.
解答 解:A、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠由2个钠离子和1个过氧根构成,故0.1mol过氧化钠中含0.1mol阴离子即0.1NA个,故A正确;
B、碳酸根为弱酸根,在溶液中会水解,故溶液中的碳酸根的个数小于0.1NA个,故B错误;
C、Na2S和Na2O2的摩尔质量均为78g/mol,故7.8g混合物的物质的量为0.1mol,由于两者均含2个阳离子,故0.1mol混合物中含0.2mol阳离子即0.2NA个,故C错误;
D、12gNaHSO4晶体的物质的量n=$\frac{12g}{120g/mol}$=0.1mol,而NaHSO4晶体由一个钠离子和一个硫氢根离子构成,故0.1mol该晶体中含0.2mol离子即0.2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
10.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 | |
| B. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 纯银器表面在空气中因化学腐蚀渐渐变暗 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
8.在101kPa和298K时,有关反应的热化学方程式有:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
下列说法错误的是( )
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
下列说法错误的是( )
| A. | H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 | |
| B. | O2前面的$\frac{1}{2}$表示参加反应的O2的分子数目 | |
| C. | 燃烧热是以在101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量定义的,则H2的燃烧热为285.8 kJ•mol-1 | |
| D. | 1 mol H2和$\frac{1}{2}$ mol O2所具有的总能量大于1mol H2O(g)所具有的总能量 |
15.下列关于物质的鉴别、分离和提纯的说法中,正确的是( )
| A. | HN03溶液混有H2SO4,可加入适量的BaCl2溶液,过滤除去 | |
| B. | 向某溶液中加入稀H2SO4,有无色无味气体生成,说明原溶液中一定含有CO32- | |
| C. | 乙酸乙酯(沸点77℃)中混有乙醇,可以用蒸馏法提纯 | |
| D. | 饱和食盐水可以除去Cl2中的HCl气体 |
5.向含amol NaOH的溶液中通入bmol CO2,溶液中产生Na2CO3的物质的量为( )
①bmol ②amol ③0 ④(a-b)mol ⑤(a+b)mol.
①bmol ②amol ③0 ④(a-b)mol ⑤(a+b)mol.
| A. | ①⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③④ |
12.下列化学用语正确的是( )
| A. | Na+的电子排布图: | |
| B. | HF的电子式: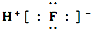 | |
| C. | Fe2+的核外电子排布式:1s22s22p63s23p63d6 | |
| D. | N2的结构简式::N≡N: |
16.取相同物质的量浓度、相同体积的(NH4)3PO4,(NH4)2HPO4,NH4H2PO4种溶液,分别滴加NaOH溶液直至恰好完全反应,则3种溶液耗用NaOH溶液的体积之比是( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 1:1:1 | D. | 6:3:2 |