题目内容
4.试写出1mol Br2和1mol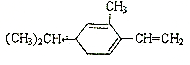 反应生成的化合物的结构简式.
反应生成的化合物的结构简式.
分析  中的双键均可以被溴单质加成,1mol Br2和只能加成1mol碳碳双键,据此分析解答.
中的双键均可以被溴单质加成,1mol Br2和只能加成1mol碳碳双键,据此分析解答.
解答 解:溴单质能和 碳碳双键发生加成反应,1mol Br2和只能加成1mol碳碳双键,所以1mol Br2和1mol 反应生成的化合物的结构简式为:
反应生成的化合物的结构简式为: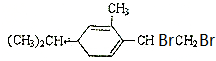 、或
、或 、或
、或 ,
,
答:反应生成的化合物的结构简式为: 、或
、或 、或
、或 .
.
点评 本题考查了有机物的结构与性质,掌握碳碳双键的性质是解答的关键,题目难度不大.

练习册系列答案
相关题目
14.12mol•L-1盐酸的密度为1.19g•cm-3,现取12mol•L-1盐酸100mL,加多少毫升水才能配成密度为1.1g•cm-3的6mol•L-1的盐酸( )
| A. | 100mL | B. | 99mL | C. | 101mL | D. | 98mL |
15.下列关于物质的鉴别、分离和提纯的说法中,正确的是( )
| A. | HN03溶液混有H2SO4,可加入适量的BaCl2溶液,过滤除去 | |
| B. | 向某溶液中加入稀H2SO4,有无色无味气体生成,说明原溶液中一定含有CO32- | |
| C. | 乙酸乙酯(沸点77℃)中混有乙醇,可以用蒸馏法提纯 | |
| D. | 饱和食盐水可以除去Cl2中的HCl气体 |
12.下列化学用语正确的是( )
| A. | Na+的电子排布图: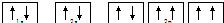 | |
| B. | HF的电子式: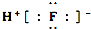 | |
| C. | Fe2+的核外电子排布式:1s22s22p63s23p63d6 | |
| D. | N2的结构简式::N≡N: |
19.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
(1)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4;
(2)比较①与⑤的最高价氧化物对应的水化物,酸性强的是H2CO3(填化学式);能通过说明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(写反应的化学方程式).
(3)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因3NO2+H2O=2HNO3+NO(用化学方程式表示)
(5)比较③与⑥的氢化物,更稳定H2O(填化学式)
(6)③④两元素组成的化合物A2B2型电子式为: ,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
(7)⑨的单质与水反应所得离子化合物中阳离子半径<S2-(填“>”或“<”).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)比较①与⑤的最高价氧化物对应的水化物,酸性强的是H2CO3(填化学式);能通过说明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(写反应的化学方程式).
(3)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因3NO2+H2O=2HNO3+NO(用化学方程式表示)
(5)比较③与⑥的氢化物,更稳定H2O(填化学式)
(6)③④两元素组成的化合物A2B2型电子式为:
 ,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.(7)⑨的单质与水反应所得离子化合物中阳离子半径<S2-(填“>”或“<”).
20.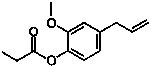 如图的有机物,则该有机物可发生的反应类型有( )
如图的有机物,则该有机物可发生的反应类型有( )
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦加聚.
 如图的有机物,则该有机物可发生的反应类型有( )
如图的有机物,则该有机物可发生的反应类型有( )①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦加聚.
| A. | ①②④⑤⑥ | B. | ①②③⑤⑦ | C. | ①②⑤⑥⑦ | D. | ①②④⑤⑦ |
 实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.