题目内容
17.下列定律或原理:①质量守恒定律,②能量守恒定律,③元素周期律,④勒夏特列原理,其中能够适用于2NH3(g)?N2(g)+3H2(g)△H<0这一化学反应的是( )| A. | 只有④ | B. | ①和③ | C. | ①②④ | D. | ①②③ |
分析 任何化学反应中都存在质量守恒定律、能量守恒定律,可逆反应中遵循勒夏特里原理,有关物质结构和性质遵循元素周期律,据此分析解答.
解答 解:任何化学反应中都存在质量守恒定律、能量守恒定律,可逆反应中遵循勒夏特里原理,有关物质结构和性质遵循元素周期律,该反应是一个反应前后气体体积减小的可逆反应,所以遵循质量守恒定律、能量守恒定律、勒夏特里原理,不涉及物质结构和性质,所以不涉及元素周期律,故选C.
点评 本题考查化学反应遵循规律,明确各个规律适用范围是解本题关键,熟悉这几个定律或原理的内涵,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
7.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则下列说法正确的是( )
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 甲、乙、丙的氧化物均为共价化合物 | |
| D. | 乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
8.常温下水的离子积常数为K1;90℃水的离子积常数为K2,则K1、K2的关系是( )
| A. | K1>K2 | B. | K1<K2 | ||
| C. | K1=K2 | D. | 视溶液的酸碱性而定 |
5.下列结论错误的是( )
| A. | 氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 | |
| B. | 微粒半径:K+>Al3+>S2->Cl- | |
| C. | 酸性:H2SO4>CH3COOH>H2CO3>HClO | |
| D. | 金属性:K>Ca>Mg>Be |
12.下列每组的三种物质中,两边的固体均用导线连接,插入中间的液体中,其中能组成原电池的是( )
| A. | Fe|H2SO4(稀)|石墨 | B. | Cu|H2SO4(稀)|Cu | C. | Cu|CCl4|Ag | D. | Zn|蔗糖溶液|Cu |
2.下列设备工作时,将化学能转化为热能的是( )
| A. | 手机电池 | B. | 硅太阳能电池 | C. | 燃气灶 | D. | 太阳能热水器 |
9.某有机物的结构简式如图,关于该有机物性质的描述不正确的是( )
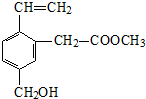
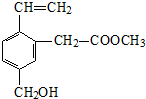
| A. | 能发生水解反应 | B. | 能发生酯化反应 | ||
| C. | 不易溶于水 | D. | 不能使酸性KMnO4溶液褪色 |
7.在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,若有8.7g MnO2参加反应,则被氧化的HCl的质量为( )
| A. | 14.6g | B. | 7.3g | C. | 3.65g | D. | 0.73g |