题目内容
18.用如图所示的装置进行实验,回答下列问题: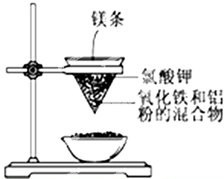
(1)写出该反应的化学方程式:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe
(2)在该反应中Fe2O3是氧化剂,Al是还原剂.
(3)选出该实验的实验现象(把序号填写在横线上)①②③④.
①镁条剧烈燃烧;
②放出大量的热,并发出耀眼的光芒,火星四射;
③纸漏斗的下部被烧穿;
④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体.
(4)说明该反应在工业上的两个用途:冶炼金属、焊接钢轨.
(5)写出铝粉与二氧化锰反应的化学方程式:3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn.
分析 (1)氧化铁和铝粉在高温条件下发生铝热反应生成铁和氧化铝;
(2)根据化合价变化判断氧化剂、还原剂;
(3)根据铝热反应的反应现象“反应放出大量的热,并发出耀眼的光,纸漏斗的下部被烧穿,有熔融物落入沙中”等现象进行判断;
(4)利用铝热反应可以冶炼金属、焊接钢轨;
(5)铝粉与二氧化锰在高温下反应生成氧化铝和锰,据此写出反应方程式.
解答 解:(1)氧化铁和铝粉在高温条件下发生铝热反应生成铁和氧化铝,反应的化学方程式为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(2)该反应中Fe2O3化合价降低被还原,作氧化剂;Al的化合价升高被氧化,作还原剂,该反应为铝热反应,
故答案为:Fe2O3;Al;
(3)该反应在高温条件下进行,反应的现象有:镁条剧烈燃烧、放出大量的热,并发出耀眼的光芒,火星四射、纸漏斗的下部被烧穿、有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体,所以①②③④都正确,
故答案为:①②③④;
(4)铝热法是一种利用铝的还原性获得高熔点金属单质的方法,重要用途有:冶炼金属、焊接钢轨等,
故答案为:冶炼金属、焊接钢轨;
(5)铝粉与二氧化锰在高温下反应生成氧化铝和金属锰,反应的化学方程式为:3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn,
故答案为:3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn.
点评 本题考查了铝热反应原理及其应用,题目难度中等,注意掌握铝热反应发生原理、反应装置及正确的操作方法,明确铝热反应的现象及用途,试题培养了学生的分析能力及灵活应用能力.

| A. | K1>K2 | B. | K1<K2 | ||
| C. | K1=K2 | D. | 视溶液的酸碱性而定 |
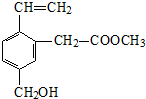
| A. | 能发生水解反应 | B. | 能发生酯化反应 | ||
| C. | 不易溶于水 | D. | 不能使酸性KMnO4溶液褪色 |
| A. | 常温常压下,16g甲烷所含的质子数为10NA | |
| B. | 常温常压下,18g重水所含的原子数为3NA | |
| C. | 标准情况下,22.4L四氯化碳所含有的分子数为NA | |
| D. | 常温常压下,1mol氦气分子所含有的核外电子数为4NA |
| A. | 乙烯使溴水褪色的反应方程式是:CH2═CH2+Br2→CH3CHBr2 | |
| B. | HOCH2CH2COOH可以发生取代反应 | |
| C. | 煤干馏可得到大量汽油和煤油 | |
| D. | 淀粉(C6H10O5)n和纤维素(C6H10O5)n互为同分异构体,其水解产物都能与新制Cu(OH)2反应生成砖红色沉淀 |
| A. | 14.6g | B. | 7.3g | C. | 3.65g | D. | 0.73g |
| A. | 用饱和的Na2SO4溶液使鸡蛋清发生盐析,进而分离、提纯蛋白质 | |
| B. | 淀粉和纤维素的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| C. | 苯酚与苯甲酸都能发生加成反应和取代反应 | |
| D. | 汽油和植物油都是碳氢化合物 |
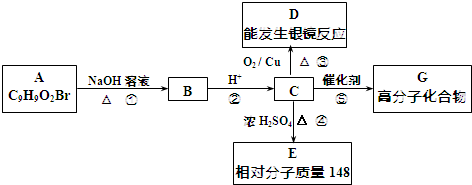
 .
.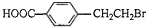 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O.反应⑤的化学方程式是
+NaBr+H2O.反应⑤的化学方程式是 .
.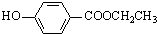 、
、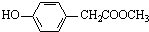 、还有4种.
、还有4种.