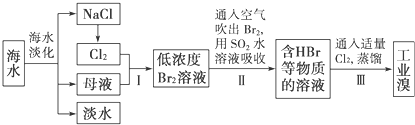
题目内容
20.下列图中所示的操作一般不用于进行物质的分离或提纯的是( )| A. |  | B. | 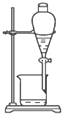 | ||
| C. | 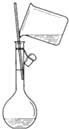 | D. | 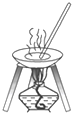 |
分析 A.图为蒸馏装置;
B.图为分液装置;
C.配制溶液不能用于分离、提纯;
D.图为蒸发装置.
解答 解:A.图为蒸馏装置,可用于沸点不同的液体分离,故A不选;
B.图为分液装置,可用于不相溶液体的分离,故B不选;
C.图为配制溶液装置,不能用于分离、提纯,故C选;
D.图为蒸发装置,用于从溶液中提取溶质,故D不选;
故选C.
点评 本题考查化学实验方案的评价,涉及溶液配制及混合物分离提纯等,把握实验装置的作用、物质性质及分离原理为解答的关键,注意方案的评价性、操作性分析,题目难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
10.下表是元素周期表的一部分,回答有关问题:
(1)写出下列元素符号:(1)N,(6)Si
(2)在这些元素中,最不活泼的元素的结构示意图是 .
.
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的与呈两性的发生反应的化学方程式为3HClO4+Al(OH)3=Al(ClO4)3+3H2O;碱性最强的与呈两性的发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)在(2)(3)(8)(10)这些元素简单离子中,离子半径由大到小的顺序是Cl->K+>F->Na+(填离子符号)
(5)元素(8)、(11)和氧元素形成一种广泛使用杀菌消毒剂,该物质中存在的化学键有离子键、共价键.
(6)用电子式表示由元素(8)和(10)形成化合物的过程: .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | (1) | (2) | ||||||
| 三 | (3) | (4) | (5) | (6) | (7) | (8) | (9) | |
| 四 | (10) | (11) | (12) |
(2)在这些元素中,最不活泼的元素的结构示意图是
 .
.(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的与呈两性的发生反应的化学方程式为3HClO4+Al(OH)3=Al(ClO4)3+3H2O;碱性最强的与呈两性的发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)在(2)(3)(8)(10)这些元素简单离子中,离子半径由大到小的顺序是Cl->K+>F->Na+(填离子符号)
(5)元素(8)、(11)和氧元素形成一种广泛使用杀菌消毒剂,该物质中存在的化学键有离子键、共价键.
(6)用电子式表示由元素(8)和(10)形成化合物的过程:
 .
.
11.有机物CH2=CH-CH2-OOC-CH3不可能具有的性质是( )
| A. | 能发生取代反应 | B. | 能发生加成反应 | C. | 能发生聚合反应 | D. | 能溶于水 |
8.元素在周期表中的位置反映了元素的性质.第3周期元素中,得电子能力最强的是( )
| A. | Na | B. | Si | C. | S | D. | Cl |
5.下列叙述正确的是( )
| A. | 无论是纯水还是酸性、碱性或中性稀溶液,常温下,其c(H+)•c(OH-)=1×10-14 | |
| B. | 某溶液由水电离出的c(OH-)=10-a mol/L,若a>7时,则该溶液的pH一定为14-a | |
| C. | 0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| D. | 任何浓度的溶液都可以用pH来表示其酸性的强弱 |
12. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:T<X | B. | R与Q的电子数相差16 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:T>Q |
10.几种短周期元素的原子半径及主要化合价见下表:
下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、R的单质与稀盐酸反应速率L<R | |
| B. | M与R性质相似 | |
| C. | Q、T两元素的氢化物沸点:T的氢化物低于Q的氢化物 | |
| D. | L、M、Q形成的简单离子半径由大到小顺序是L>M>Q |