题目内容
8.元素在周期表中的位置反映了元素的性质.第3周期元素中,得电子能力最强的是( )| A. | Na | B. | Si | C. | S | D. | Cl |
分析 同一周期元素,元素的金属性随着原子序数增大而减弱,元素的非金属性随着原子序数增大而增强,元素的非金属性越强,其得电子能力越强,据此分析解答.
解答 解:同一周期元素,元素的金属性随着原子序数增大而减弱,元素的非金属性随着原子序数增大而增强,元素的非金属性越强,其得电子能力越强,这几种元素处于同一周期,非金属性强弱顺序是Cl>S>Si>Na,所以得电子能力最强的是Cl元素,故选D.
点评 本题考查同一周期元素性质递变规律,侧重考查学生对元素周期律的综合应用,明确元素周期律内涵即可解答,题目难度不大.

练习册系列答案
相关题目
19.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子化合物,通过对CaC2制C2H2的反应进行思考,从中得到启示,判断下列碳化物水解后的有机产物相同的是( )
| A. | Zn2C | B. | Al4C3 | C. | Mg2C3 | D. | Li2C2 |
16.在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s末H2的反应速率υ(H2)=0.3mol/(L•s),则3s末NH3的浓度为( )
| A. | 0.45 mol/L | B. | 0.6 mol/L | C. | 0.9 mol/L | D. | 1.2 mol/L |
3.部分弱酸的电离平衡常数如表:
下列选项正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡 常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 2HCOOH+CO32-═2HCOO-+H2O+CO2↑ | |
| C. | 等浓度的HCOONa和NaCN溶液的pH前者大于后者 | |
| D. | 中和等浓度的HCOOH和HCN消耗NaOH的量前者等于后者 |
13.下列说法中,正确的是( )
| A. | 除去液溴中少量的氯水,可向其中加少量KI | |
| B. | 氯水和氯气均能使湿润的有色布条褪色,都是HClO作用的结果 | |
| C. | 某白色晶体与NaOH浓溶液混合,有能使湿润红色石蕊试纸变蓝的气体产生,则该晶体一定是NH4Cl | |
| D. | 某溶液能使淀粉碘化钾试纸变蓝,则溶液中一定含有Cl2 |
20.下列图中所示的操作一般不用于进行物质的分离或提纯的是( )
| A. |  | B. | 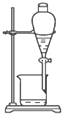 | ||
| C. | 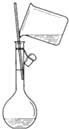 | D. | 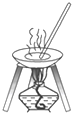 |
17.11.2L甲烷、乙烷、甲醛组成的混合气体,完全燃烧后生成15.68LCO2(气体体积均在标准状况下测定),混合气体中乙烷的体积百分含量为( )
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
18.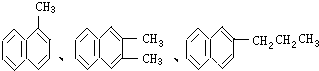 都属于萘的同系物.萘和萘的同系物分子组成通式是( )
都属于萘的同系物.萘和萘的同系物分子组成通式是( )
 都属于萘的同系物.萘和萘的同系物分子组成通式是( )
都属于萘的同系物.萘和萘的同系物分子组成通式是( )| A. | CnH2n-6(n≥11) | B. | CnH2n-8(n>10) | C. | CnH2n-10(n≥10) | D. | CnH2n-12(n≥10) |