题目内容
9.(1)现有如下两个反应:A、NaOH+HCl═NaCl+H2O,B、2FeCl3+Cu=2FeCl2+CuCl2根据两反应本质,判断能否设计成原电池:A、不能,B、能 (选择“能”或“不能”);
( 2)请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(碳棒作正极),回答下列问题:
①电池的负极材料是Cu,发生氧化反应(填“氧化”或“还原”),电解质溶液是硝酸银;
②正极上出现的现象是银白色金属析出;
(3)将铝片和镁片用导线相连,一组插入稀盐酸溶液中,一组插入稀NaOH溶液中,分别形成了原电池,则在这两个原电池中,负极的电极反应式分别为Al-3e-=Al3+ 和Al+4OH--3e-=AlO2-+2H2O.
分析 (1)含元素化合价变化的反应为氧化还原反应,可设计成原电池;
(2)Cu+2Ag+=2Ag+Cu2+中,Cu失去电子,Cu为负极,电解质为硝酸银;
(3)一组插入稀盐酸溶液中,活泼金属Mg作负极;一组插入稀NaOH溶液中,Mg与NaOH不反应,则Al作负极.
解答 解:(1)A中没有元素的化合价变化,不发生氧化还原反应;B中Cu、Fe元素的化合价变化,为氧化还原反应,且放热,则B能设计成氧化还原反应,
故答案为:不能;能;
(2)Cu+2Ag+=2Ag+Cu2+中,Cu失去电子,Cu为负极,失去电子被氧化,发生氧化反应,选择电解质为硝酸银,正极上银离子得到电子生成Ag,现象为银白色金属析出,
故答案为:Cu;氧化;硝酸银;银白色金属析出;
(3)一组插入稀盐酸溶液中,活泼金属Mg作负极,负极反应为Al-3e-=Al3+;一组插入稀NaOH溶液中,Mg与NaOH不反应,则Al作负极,则负极反应为Al+4OH--3e-=AlO2-+2H2O,故答案为:Al-3e-=Al3+;Al+4OH--3e-=AlO2-+2H2O.
点评 本题考查原电池的设计,为高频考点,把握原电池的工作原理、电极反应等为解答的关键,侧重分析与实验设计能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子化合物,通过对CaC2制C2H2的反应进行思考,从中得到启示,判断下列碳化物水解后的有机产物相同的是( )
| A. | Zn2C | B. | Al4C3 | C. | Mg2C3 | D. | Li2C2 |
20.下列图中所示的操作一般不用于进行物质的分离或提纯的是( )
| A. |  | B. | 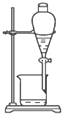 | ||
| C. | 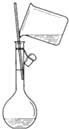 | D. | 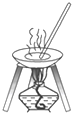 |
17.11.2L甲烷、乙烷、甲醛组成的混合气体,完全燃烧后生成15.68LCO2(气体体积均在标准状况下测定),混合气体中乙烷的体积百分含量为( )
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
4.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| C. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| D. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |
14.某一有机物A可发生如图变化:已知C为羧酸,且C、E不发生银镜反应,则A的可能结构有( )
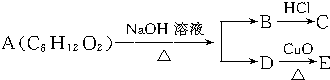
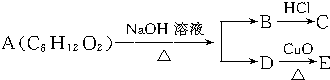
| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
1.某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几钟.将X通过适量的氯水时,X完全被吸收.将所得的无色溶液分装于两支试管后,分别加入酸化AgNO3与BaCl2溶液,结果均产生白色沉淀.下列推论正确的是( )
| A. | X中可能有HBr | B. | X中一定有SO2 | C. | X中可能有CO2 | D. | X中一定有HCl |
18.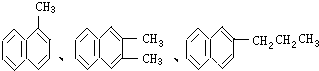 都属于萘的同系物.萘和萘的同系物分子组成通式是( )
都属于萘的同系物.萘和萘的同系物分子组成通式是( )
 都属于萘的同系物.萘和萘的同系物分子组成通式是( )
都属于萘的同系物.萘和萘的同系物分子组成通式是( )| A. | CnH2n-6(n≥11) | B. | CnH2n-8(n>10) | C. | CnH2n-10(n≥10) | D. | CnH2n-12(n≥10) |
19.有五种元素X、Y、Z、Q、T、X元素为主族元素,X原子的M层上有两个未成对电子且无空轨迹;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p亚层上有一个空轨道;Q原子的L电子层的p亚层上有一对成对电子;T原子的M电子层上p轨道半充满.下列叙述不正确的是( )
| A. | 元素Y和Q可形成一种化合物Y2Q3 | |
| B. | T有一种单质的空间型为正四面体形 | |
| C. | X和Q结合生成的化合物为离子化合物 | |
| D. | ZO2是极性键构成的非极性分子 |