题目内容
10.几种短周期元素的原子半径及主要化合价见下表:| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、R的单质与稀盐酸反应速率L<R | |
| B. | M与R性质相似 | |
| C. | Q、T两元素的氢化物沸点:T的氢化物低于Q的氢化物 | |
| D. | L、M、Q形成的简单离子半径由大到小顺序是L>M>Q |
分析 短周期元素中,L和R的化合价都为+2价,应处于ⅡA族,L的原子半径较大,故R为Be,L为Mg;Q和T的化合价都有-2价,处于ⅥA族,Q的最高价为+6价,T无正价,则Q为S元素,T为O元素;M的化合价为+3价,应为周期表第ⅢA族元素,M原子半径大于S、小于Mg,则M为Al元素,结合元素周期律知识解答该题.
解答 解:短周期元素中,L和R的化合价都为+2价,应处于ⅡA族,L的原子半径较大,故R为Be,L为Mg;Q和T的化合价都有-2价,处于ⅥA族,Q的最高价为+6价,T无正价,则Q为S元素,T为O元素;M的化合价为+3价,应为周期表第ⅢA族元素,M原子半径大于S、小于Mg,则M为Al元素.
A.金属性Mg>Be,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为L>R,故A错误;
B.R为Be,M为Al,Be与Al位于周期表对角线位置,性质相似,故B正确;
C.水分子之间存在氢键,沸点高于硫化氢,故C错误;
D.Mg2+、Al3+、O2-离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Mg2+>Al3+,故D错误,
故选B.
点评 本题考查位置结构性质的关系应用,题目难度中等,根据元素化合价、原子半径推断元素是解答该题的关键,注意理解元素周期律的递变规律.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
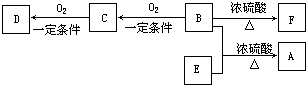
20.下列图中所示的操作一般不用于进行物质的分离或提纯的是( )
| A. |  | B. | 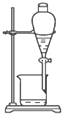 | ||
| C. | 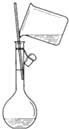 | D. | 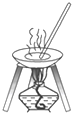 |
1.某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几钟.将X通过适量的氯水时,X完全被吸收.将所得的无色溶液分装于两支试管后,分别加入酸化AgNO3与BaCl2溶液,结果均产生白色沉淀.下列推论正确的是( )
| A. | X中可能有HBr | B. | X中一定有SO2 | C. | X中可能有CO2 | D. | X中一定有HCl |
18.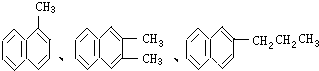 都属于萘的同系物.萘和萘的同系物分子组成通式是( )
都属于萘的同系物.萘和萘的同系物分子组成通式是( )
 都属于萘的同系物.萘和萘的同系物分子组成通式是( )
都属于萘的同系物.萘和萘的同系物分子组成通式是( )| A. | CnH2n-6(n≥11) | B. | CnH2n-8(n>10) | C. | CnH2n-10(n≥10) | D. | CnH2n-12(n≥10) |
15.与氨碱法比较,下列关于联合制碱法优点的判断中不正确的是( )
| A. | 提高了原料利用率 | B. | 降低了生产成本 | ||
| C. | 减少了环境污染 | D. | 减轻了对设备的腐蚀 |
2.由下列结构片段组成的蛋白质在胃液中水解,不可能产生的氨基酸是( )
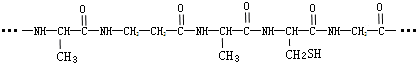

| A. | 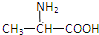 | B. | H2NCH2COOH | C. | 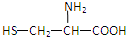 | D. | 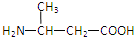 |
19.有五种元素X、Y、Z、Q、T、X元素为主族元素,X原子的M层上有两个未成对电子且无空轨迹;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p亚层上有一个空轨道;Q原子的L电子层的p亚层上有一对成对电子;T原子的M电子层上p轨道半充满.下列叙述不正确的是( )
| A. | 元素Y和Q可形成一种化合物Y2Q3 | |
| B. | T有一种单质的空间型为正四面体形 | |
| C. | X和Q结合生成的化合物为离子化合物 | |
| D. | ZO2是极性键构成的非极性分子 |
14.乙酸香兰酯是用于调配奶油、冰淇淋的食用香精,其合成反应的化学方程式如下:下列叙述正确的是( )
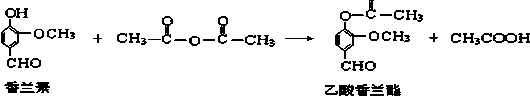
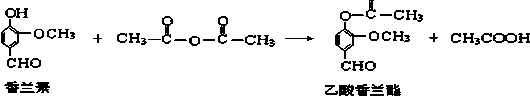
| A. | 该反应属于加成反应 | |
| B. | FeCl3溶液可用于区别香兰素与乙酸香兰酯 | |
| C. | 乙酸香兰酯的分子式为C10H8O4 | |
| D. | 乙酸香兰酯在足量NaOH溶液中水解得到乙酸和香兰素 |