题目内容
6.短周期元素A、B、C、D、E的原子序数依次增大,已知:①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐;
②A的氧化物是生活中最常见液体,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种离子化合物F,其组成原子数之比为5:1:1:3.
请回答下列问题:
(1)C的气态氢化物的电子式为
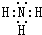 ,A在周期表中的位置第一周期第ⅠA族.
,A在周期表中的位置第一周期第ⅠA族.(2)化合物E2D2中阴、阳离子个数比为1:2,F含有的化学键类型为离子键、共价键.
(3)F溶液与足量EDA的稀溶液混合,其离子方程式为2OH-+HCO3-+NH4+═CO32-+H2O+NH3•H2O.
(4)氯气与C的气态氢化物相遇有白烟及C2生成,写出其化学反应方程式3Cl2+8NH3=6NH4Cl+N2.
(5)C2A4空气燃料电池是一种环境友好的碱性燃料电池,电解质溶液是20%~30% KOH溶液.该燃料电池的正极反应式为N2H4-4e-+4OH-═N2+4H2O.
分析 短周期元素A、B、C、D、E的原子序数依次增大,①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐M,则C为N元素,M为NH4NO3;②A的氧化物是生活中最常见液体,该液体应是水,结合原子序数可知,则A为H元素;A、E同主族,E的原子序数大于氮,则E为Na元素;C与B、D相邻,B、D原子序数均小于Na,可推知B为碳元素、D为O元素;③A、B、C、D四种元素组成一种离子化合物F,其组成原子数之比为5:1:1:3,则F为NH4HCO3,据此解答.
解答 解:短周期元素A、B、C、D、E的原子序数依次增大,①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐M,则C为N元素,M为NH4NO3;②A的氧化物是生活中最常见液体,该液体应是水,结合原子序数可知,则A为H元素;A、E同主族,E的原子序数大于氮,则E为Na元素;C与B、D相邻,B、D原子序数均小于Na,可推知B为碳元素、D为O元素;③A、B、C、D四种元素组成一种离子化合物F,其组成原子数之比为5:1:1:3,则F为NH4HCO3,
(1)C的气态氢化物为NH3,其电子式为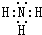 ,A为氢元素,周期表中位置是第一周期第ⅠA族,
,A为氢元素,周期表中位置是第一周期第ⅠA族,
故答案为: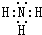 ;第一周期第ⅠA族;
;第一周期第ⅠA族;
(2)化合物E2D2为Na2O2,由钠离子与过氧根离子构成,阴阳离子个数比为1:2,F为NH4HCO3,含有离子键、共价键,
故答案为:1:2;离子键、共价键;
(3)NH4HCO3溶液与足量NaOH的稀溶液混合,反应生成碳酸钠与一水合氨,反应离子方程式为:2OH-+HCO3-+NH4+═CO32-+H2O+NH3•H2O,
故答案为:2OH-+HCO3-+NH4+═CO32-+H2O+NH3•H2O;
(4)C的气态氢化物为NH3,氯气与NH3相遇有白烟及N2生成,生成的白烟为NH4Cl,其化学反应方程式为3Cl2+8NH3=6NH4Cl+N2,
故答案为:3Cl2+8NH3=6NH4Cl+N2;
(5)N2H4空气燃料电池中,是还原剂,N2H4在正极发生氧化反应,氧气是氧化剂在负极发生氧化反应,在KOH溶液中该燃料电池的正极反应式为N2H4-4e-+4OH-═N2+4H2O,
故答案为:N2H4-4e-+4OH-═N2+4H2O.
点评 本题考查位置结构性质的应用,涉及常用化学用语、元素化合物性质、氧化还原反应、原电池等,难度中等,推断元素是解题的关键,(3)中离子方程式书写为易错点,注意氢氧根离子足量,铵根离子与碳酸氢根均反应,且为稀溶液,得到一水合氨.

| A. | 含共价键的共价化合物一定是分子晶体,分子晶体一定含共价键 | |
| B. | 固态可以导电的是离子晶体和金属晶体 | |
| C. | 由原子构成的晶体一定是原子晶体,由分子构成的晶体一定是分子晶体 | |
| D. | 判定晶体为离子晶体还是分子晶体的方法是看其熔融态是否能导电 |
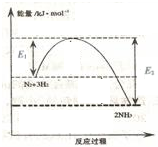 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.(1)如图表示一定温度和压强下氨气和氢气合成氨反应过程中的能量变化,则合成氨反应为放热(填“吸热”或“放热”)反应.
(2)在一定温度下,在2L密闭容器中加入催化剂并通入0.1molNH3(g),发生反应:2NH3?N2+3H2,不同时间产生N2的物质的量见下表:
| 时间/min | 20 | 60 | 40 | 80 |
| n(N2)/mol | 0.016 | 0.032 | 0.040 | 0.040 |
②达到平衡后,容器中c(NH3)═0.01mol/L.
③若在1L密闭容器中加入催化剂并通入0.1mol NH3(g),则容器中的反应速率比原容器的快(填“快”或“慢”).
| X | Y | ||
| Z | W | Q |
| A. | X、W分别与钠形成的化合物摩尔质量相同,且每种化合物中阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为离子化合物 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
| A. | 1H216O | B. | 1H218O | C. | 2H216O | D. | 2H218O |
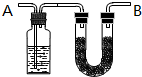 将含有C、H、O的有机物3.24g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过管A和管B,测得A管质量增加了2.16g,B管增加了9.24g,已知该有机物的相对分子质量为108.
将含有C、H、O的有机物3.24g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过管A和管B,测得A管质量增加了2.16g,B管增加了9.24g,已知该有机物的相对分子质量为108. .
.
 .
. 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答: