题目内容
7.下列与金属腐蚀有关的说法正确的是( )| A. |  图中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 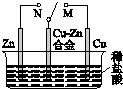 图中,开关由M改置于N时,Cu-Zn合金的腐蚀速率加快 | |
| C. | 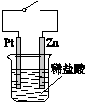 图中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 | |
| D. | 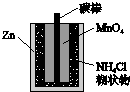 图中,Zn-MnO2干电池为一次性电池,将NH4Cl换成湿的KOH后电池性能更好 |
分析 A.越靠近底端,越不易腐蚀;
B.开关由M改置于N时,Zn为负极,合金为正极;
C.接通开关时,如Zn连接电源负极,则不易腐蚀;
D.NH4Cl溶液水解显酸性,能和锌反应.
解答 解:A.越靠近底端,氧气的含量越少,越不易腐蚀,故A错误;
B.开关由N改置于M时,合金为负极,则Cu-Zn合金的腐蚀速率加快,故B错误;
C.接通开关时,Zn为负极,则不会产生气体,Pt上生成氢气,故C错误;
D.NH4Cl溶液水解显酸性,能和锌反应,导致锌皮变薄,换成KOH后性能更好,故D正确.
故选D.
点评 本题综合考查电化学知识,侧重于金属的腐蚀与防护以及原电池的工作原理的考查,题目难度不大,注意把握电极反应.

练习册系列答案
相关题目
20.某同学进行试验探究时,欲配制1.0mol•L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2•8H2O试剂(化学式量:315).在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物.为探究原因,该同学查得Ba(OH)2•8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6.
(1)烧杯中未溶物仅为BaCO3,理由是Ba(OH)2•8H2O与CO2作用转化为BaCO3
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
(3)将试剂初步提纯后,准确测定其中Ba(OH)2•8H2O的含量.实验如下:
①配制250ml 约0.1mol•L-1Ba(OH)2•8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,溶解、过滤,将溶液转入250ml容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将0.1980 (填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
(4)室温下,不能(填“能”或“不能”) 配制1.0mol•L-1Ba(OH)2溶液.
(1)烧杯中未溶物仅为BaCO3,理由是Ba(OH)2•8H2O与CO2作用转化为BaCO3
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | |
| 步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中 | |
| 步骤4: |
①配制250ml 约0.1mol•L-1Ba(OH)2•8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,溶解、过滤,将溶液转入250ml容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将0.1980 (填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
(4)室温下,不能(填“能”或“不能”) 配制1.0mol•L-1Ba(OH)2溶液.
15.对于某些离子的检验方法(包括操作、现象、结论),完全正确的是( )
| A. | 向待测溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- | |
| B. | 向待测溶液中逐滴加入氢氧化钠溶液,开始有白色沉淀生成,继续滴加氢氧化钠溶液到过量,沉淀逐渐溶解,一定有Al3+ | |
| C. | 向待测溶液中先滴加盐酸酸化未出现沉淀,再加入BaCl2 溶液有白色沉淀产生,一定有SO42- | |
| D. | 向待测溶液中滴加NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,一定有NH4+ |
2.X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
(1)W在元素周期表的位置是第三周期第ⅣA族;W的原子半径比X的大(填“大”或“小”).
(2)X、Y、W气态氢化物的稳定性大小顺序H2O>CH4>SiH4(用化学式表示).
(3)写出Y单质的电子式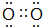 .
.
(4)振荡下,向Z单质与盐酸反应后的无色溶液中逐滴滴加NaOH溶液直至过量,能观察到的现象是先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;W的单质与氢氟酸反应的化学方程式是Si+4HF=SiF4↑+2H2↑.
(5)在25℃、101kPa下,已知13.5g的Z单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的单质能与强酸、强碱溶液反应放出氢气 |
| W | W的一种核素的质量数为28,中子数为14 |
(2)X、Y、W气态氢化物的稳定性大小顺序H2O>CH4>SiH4(用化学式表示).
(3)写出Y单质的电子式
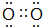 .
.(4)振荡下,向Z单质与盐酸反应后的无色溶液中逐滴滴加NaOH溶液直至过量,能观察到的现象是先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;W的单质与氢氟酸反应的化学方程式是Si+4HF=SiF4↑+2H2↑.
(5)在25℃、101kPa下,已知13.5g的Z单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
12.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | Na2CO3溶液呈碱性:CO32-+2H2O?H2CO3+2OH- | |
| C. | 氯化镁溶液与氨水反应:Mg2++2NH3•H2O═2NH4++Mg(OH)2↓ | |
| D. | 氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-++ClO- |
19.下列叙述正确的是( )
| A. | 合成高分子材料都难以降解,会造成环境污染 | |
| B. | 塑料、涂料和合成橡胶被称为“三大合成材料” | |
| C. | 食品包装袋、食物保鲜膜等材料的主要成分是聚氯乙烯 | |
| D. | 用于生产“尿不湿”的高吸水性树脂属于功能高分子材料 |
16.下列离子方程式正确的是( )
| A. | 氨水和盐酸反应:OH-+H+═H2O | |
| B. | 稀硫酸中滴加氢氧化钡溶液:H++OH-═H2O | |
| C. | 碳酸钙中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu |
17.某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究,实验过程如图,下列说法不正确的是( )

| A. | ①和②都是过滤操作 | |
| B. | 滤渣的成分是Cu和Fe的混合物 | |
| C. | 操作③和④都是在蒸发皿中进行 | |
| D. | 溶液B中反应的离子方程式:4Fe2++O2+8NH3+10H2O═8NH4++4Fe(OH)3↓ |
 .
.