题目内容
11.催化氧化法是工业制硫酸的常用方法,将SO2转化为SO3是其中的关键步骤.(1)已知25℃、101kPa时:
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H1=-544kJ/mol
H2O(g)═H2O(l)△H2=-44kJ/mol
SO3(g)+H2O(l)═H2SO4(l)△H3=-130kJ/mol
则2SO2(g)+O2(g)?2SO3(g)△H=-196KJ/mol
(2)下列关于反应2SO2(g)+O2(g)?2SO3(g)的说法正确是BD
A.升温可以加快合成SO3的速率同时提高SO2的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.该反应在任何条件下都能自发进行
D.当2ν(O2生成)=ν(SO2消耗)时,说明反应达到平衡状态
(3)t℃时,在100L容积固定的密闭容器中加入4.0mol SO2(g)和2.0mol O2(g),发生反应2SO2(g)+O2(g)?2SO3(g),平衡时压强为初始压强的$\frac{5}{6}$倍,该温度下平衡常数K=100L/mol.
①若温度不变,再加入1.0mol O2后重新达到平衡,则O2的转化率减小(填“增大”、“不变”或“减小”),SO3的体积分数减小(填“增大”、“不变”或“减小”).
②若温度不变,将容器容积从100L缩小到50L时,则平衡向正(填“正”或“逆”)反应方向移动请结合化学平衡常数来说明平衡移动的原因,要求写出推导过程当恒温下,容器容积从100L缩小到50L时,Qc=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$=$\frac{(\frac{2}{50})^{2}}{(\frac{2}{50})^{2}×\frac{1}{50}}$=50<K,所以反应将正向移动达到平衡.
(4)下列关于2SO2(g)+O2(g)?2SO3(g)反应的图象中,可能正确的是ACD(填序号).

(5)SO2的尾气处理常用亚硫酸钠吸收法,常温下当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是AB
A.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c (OH-)
B.c(H+)+c (H2SO3)=c (SO32-)+c (OH-)
C.c(Na+)>c (HSO3-)>c(SO32-)>c(H+)
D.水电离的c(H+)>1×10-7mol•L-1.
分析 (1)依据热化学方程式和盖斯定律计算所需热化学方程式,依据盖斯定律①+②×2-2×③计算得到;
(2)反应是气体体积减小的放热反应,结合化学平衡移动原理分析判断选项;
(3)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,气体压强之比等于气体物质的量之比,结合化学平衡三段式列式计算;
①若温度不变,再加入1.0molO2,平衡向正反应移动,重新达到平衡,二氧化硫的转化率增大,三氧化硫含量减小;
②当恒温下,容器容积从100L缩小到50L时,压强增大,平衡正向进行,计算此时浓度商和平衡常数比较判断反应进行的方向;
(4)A、先拐先平压强大,平衡正向进行,三氧化硫体积分数增大;
B、温度升高正逆反应速率增大,反应是放热反应,升温平衡逆向进行,逆反应速率增大的多;
C、随温度升高,反应正向进行达到平衡状态,继续升温平衡逆向进行,三氧化硫体积分数减小;
D、图象分析可知,正反应速率减小后,增大比原来的正反应速率大,增大三氧化硫浓度,同时减少二氧化硫浓度,平衡逆向进行;
(5)A.根据电荷守恒判断;
B.根据物料守恒判断;
C.NaHSO3溶液中HSO3-的电离程度大于其水解程度;
D.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于NaHSO3溶液的pH未知,不能计算水电离出氢离子浓度.
解答 解:(1)①2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H1=-544kJ/mol
②H2O(g)═H2O(l)△H2=-44kJ/mol
③SO3(g)+H2O(l)═H2SO4(l)△H3=-130kJ/mol
依据盖斯定律①+②×2-2×③得到:2SO2(g)+O2(g)?2SO3(g)△H=-196KJ/mol,
故答案为:-196KJ/mol;
(2)2SO2(g)+O2(g)?2SO3(g),反应是气体体积减小的放热反应,
A.升温平衡逆向进行,可以加快合成SO3的速率,但不能提高SO2的转化率,故A错误;
B.催化剂能加快反应速率,不改变化学平衡,寻找常温下的合适催化剂减少能源利用是未来研究的方向,故B正确;
C.该反应在任何条件下都能自发进行,反应焓变△H<0,△S<0,低温下自发进行,高温可能存在△H-T△S>0,故C错误;
D.反应速率之比等于化学方程式计量数之比,当2ν(O2生成)=ν(SO2消耗)时,说明二氧化硫的正逆反应速率相同,说明反应达到平衡状态,故D正确;
故答案为:BD;
(3)t℃时,在100L容积固定的密闭容器中加入4.0mol SO2(g)和2.0mol O2(g),发生反应2SO2(g)+O2(g)?2SO3(g),设反应的氧气物质的量为x,
2SO2(g)+O2(g)?2SO3(g),
起始量(mol) 4 2 0
变化量(mol) 2x x 2x
平衡量(mol) 4-2x 2-x 2x
平衡时压强为初始压强的$\frac{5}{6}$倍,
4-2x+2-x+2x=$\frac{5}{6}$×(4+2)
x=1
平衡常数K=$\frac{(\frac{2}{100})^{2}}{(\frac{2}{100})^{2}×\frac{1}{100}}$=100L/mol,
故答案为:100L/mol;
①两种物质,增加其中一种,会提高另一种的转化率,若温度不变,再加入1.0mol O2后重新达到平衡,则O2的转化率减小,氧气的量增多,转化的小于加入的物质的量,SO3的体积分数反而减小,故答案为:减小;减小;
②当恒温下,容器容积从100L缩小到50L时,压强增大,平衡正向进行,此时浓度商Qc=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$=$\frac{(\frac{2}{50})^{2}}{(\frac{2}{50})^{2}×\frac{1}{50}}$=50<K,所以反应将正向移动达到平衡
故答案为:正;当恒温下,容器容积从100L缩小到50 L时,Qc=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$=$\frac{(\frac{2}{50})^{2}}{(\frac{2}{50})^{2}×\frac{1}{50}}$=50<K,所以反应将正向移动达到平衡;
(4)A、先拐先平压强大,平衡正向进行,三氧化硫体积分数增大,图象符合化学平衡移动原理,故A正确;
B、温度升高正逆反应速率增大,反应是放热反应,升温平衡逆向进行,逆反应速率增大的多,图象中反应速率变化不符合化学平衡移动原理,故B错误;
C、随温度升高,反应正向进行达到平衡状态,继续升温平衡逆向进行,三氧化硫体积分数减小,图象变化符合反应进行过程和平衡移动原理,故C正确;
D、图象分析可知,正反应速率减小后,增大比原来的正反应速率大,增大三氧化硫浓度,同时减少二氧化硫浓度,平衡逆向进行,图象变化符合化学平衡的移动原理和变化,故D正确;
故答案为:ACD;
(5)A.根据电荷守恒:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故溶液中c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-),故A正确;
B.溶液中S元素以SO32-、HSO3-、H2SO3形式存在,Na元素与硫元素物质的量之比为1:1,故溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),电荷守恒为:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),合并得到c(H+)+c (H2SO3)=c (SO32-)+c (OH-),故B正确;
C.NaHSO3溶液中HSO3-的电离程度大于其水解程度,故溶液中c(Na+)>c(HSO3-)>c(H+)>c(SO32-),故C错误;
D.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于NaHSO3溶液的pH未知,不能计算水电离出氢离子浓度,故D错误,
故答案为:AB.
点评 本题考查了热化学方程式书写和盖斯定律的计算应用,化学平衡移动原理应用和平衡影响因素的分析判断,平衡常数概念计算分析,掌握基础是关键,题目难度中等.

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案| A. | C3H8$\stackrel{极高温}{→}$3C+4H2 | |
| B. | C3H8$\stackrel{高温脱氢}{→}$C3H6+H2 | |
| C. | C3H8+3H2O$\stackrel{催化剂}{→}$3CO+7H2 | |
| D. | C3H8+5O2→3CO2+4H2O,2H2O$\stackrel{电解}{→}$2H2↑+O2↑ |
| A. | 食盐和油都是生活必需品.加碘盐中的碘以碘化钾的形式存在;而植物油变质是由于发生了酯化反应 | |
| B. | “神十”搭载的长二F改进型火箭推进剂是偏二甲肼(C2H8N2)和四氧化二氮,其中四氧化二氮作氧化剂 | |
| C. | 镁铝合金可用作制造飞机的材料 | |
| D. | 近期正热播柴静的雾霾调查纪录片《穹顶之下》.PM2.5是灰霾天气的主要原因,是指大气中直径小于或等于2.5微米的颗粒物,也叫可入肺颗粒物,与肺癌、哮喘等疾病的发生密切相关,它主要来自化石燃料的燃烧(如机动车尾气、燃煤)等 |
| A. | 只有①② | B. | 只有①④ | C. | 只有①③④ | D. | ①②③④ |
(1)烧杯中未溶物仅为BaCO3,理由是Ba(OH)2•8H2O与CO2作用转化为BaCO3
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | |
| 步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中 | |
| 步骤4: |
①配制250ml 约0.1mol•L-1Ba(OH)2•8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,溶解、过滤,将溶液转入250ml容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将0.1980 (填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
(4)室温下,不能(填“能”或“不能”) 配制1.0mol•L-1Ba(OH)2溶液.

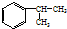 ,A的芳香烃同分异构体(除A外)有7种.
,A的芳香烃同分异构体(除A外)有7种. .反应类型为加成反应.
.反应类型为加成反应. )是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式
)是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式 .
. .
.

 .
.