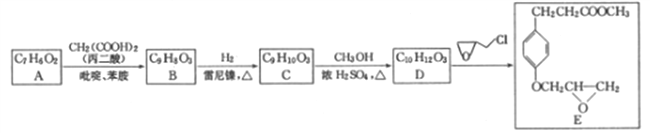
题目内容
【题目】黄铜矿是一种重要的化工原料,主要成分是CuFeS2,另外还有少量的氧化铝、二氧化硅及水分,通过化学工艺可获得许多化工产品。
(1)铜元素位于元素周期表中_________(填写周期、族);基态Fe原子的价层电子轨道表达式为_____;
(2)硫位于第VIA 族,该族元素氢化物沸点由低到高的顺序及原因是_________(必要化学用语及文字简答)。
(3)基态氮原子的第一电离能大于氧原子的第一电离能的原因是__________。
(4)由铝和氯元素组成的化合物熔点190℃、在熔融态不导电;该化合物易升华,其蒸气密度是相同条件下氢气的133.5倍。请写出其蒸气分子的结构式______________(如有配位键,请 用“→”表 示 )。(5)黄铜矿在空气中高温灼烧可以得到固体混合物和废气,固体混合物中有X和Y两化合物。固体化合物X的晶胞模型如图甲所示:
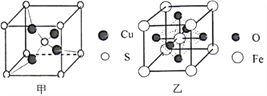
①化合物X的化学式:___________;
②废气中SO2经催化氧化生成SO3,SO3分子中硫原子杂化方式为___________;SO3分子空间构型是___________。
(6)黄铜矿高温灼烧得到的另一固体化合物Y的晶胞模型如图乙,已知丫晶体密度为ρg/cm3,则Y 晶体中晶胞边长是_____cm。
【答案】 第4周期第ⅠB ![]() 该族氢化物沸点由低到高的顺序为H2S、H2Se、H2Te、H2O,H2S、H2Se、H2Te因相对分子质量逐渐增大,分子间作用力增大,沸点升高;而H2O分子之间因形成的氢键大于分子间作用力,沸点更高(合理答案均计分) N原子2P轨道处于半充满,原子稳定,而O原子2P轨道需失去一个电子才能达到半充满的稳定状态(合理答案均计分)
该族氢化物沸点由低到高的顺序为H2S、H2Se、H2Te、H2O,H2S、H2Se、H2Te因相对分子质量逐渐增大,分子间作用力增大,沸点升高;而H2O分子之间因形成的氢键大于分子间作用力,沸点更高(合理答案均计分) N原子2P轨道处于半充满,原子稳定,而O原子2P轨道需失去一个电子才能达到半充满的稳定状态(合理答案均计分) 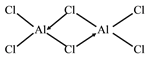 Cu2S sp2 平面三角形
Cu2S sp2 平面三角形 ![]()
【解析】(1)由元素周期表得,铜元素原子的核外电子排布由里往外依次为:2、8、18、1;位于元素周期表中第4周期第ⅠB族;正确答案:第4周期、第ⅠB。Fe原子的核外电子排布式为1s22s22p63s23p63d64s2,其3d、4s电子为其价电子,根据构造原理书写其价电子轨道表示式为 ![]() ;正确答案:
;正确答案:![]() 。
。
(2)H2S、H2Se、H2Te因相对分子质量逐渐增大,分子间作用力增大,沸点升高;而H2O分子之间因形成的氢键大于分子间作用力,沸点更高;所以该族氢化物沸点由低到高的顺序为H2S、H2Se、H2Te、H2O;正确答案:该族氢化物沸点由低到高的顺序为H2S、H2Se、H2Te、H2O,H2S、H2Se、H2Te因相对分子质量逐渐增大,分子间作用力增大,沸点升高;而H2O分子之间因形成的氢键大于分子间作用力,沸点更高。
(3)N原子2P轨道处于半充满,原子稳定,而O原子2P轨道需失去一个电子才能达到半充满的稳定状态,所以基态氮原子的第一电离能大于氧原子的第一电离能;正确答案:N原子2P轨道处于半充满,原子稳定,而O原子2P轨道需失去一个电子才能达到半充满的稳定状态。
(4)该化合物蒸气密度是相同条件下氢气的133.5倍,故该化合物相对分子质量为133.5![]() 2=267,又因为该化合物熔点190℃、在熔融态不导电,故该化合物为共价化合物,含有共价键;又因为Al与3个Cl形成共价键后,距离8电子稳定结构还差2个,这时,另外一个Cl提供2个电子,形成配位键,从而使其达到稳定结构,因为配位键箭头要指向中心原子,其蒸气分子的结构式
2=267,又因为该化合物熔点190℃、在熔融态不导电,故该化合物为共价化合物,含有共价键;又因为Al与3个Cl形成共价键后,距离8电子稳定结构还差2个,这时,另外一个Cl提供2个电子,形成配位键,从而使其达到稳定结构,因为配位键箭头要指向中心原子,其蒸气分子的结构式 ;正确答案:
;正确答案: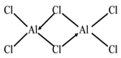 。
。
(5)Cu2S 在一个晶胞中,S:8![]() +1=2 Cu:4 ,所以化合物X的化学式为Cu2S;因为S价电子数为6,配原子提供电子数为0,由公式:(中心原子价电子数+配原子提供的电子数)/2,得(6+0
+1=2 Cu:4 ,所以化合物X的化学式为Cu2S;因为S价电子数为6,配原子提供电子数为0,由公式:(中心原子价电子数+配原子提供的电子数)/2,得(6+0![]() 3)/2=3所以为sp2,SO3分子中硫原子杂化方式为sp2,SO3分子空间构型是平面三角形;正确答案:Cu2S; sp2 ; 平面三角形。
3)/2=3所以为sp2,SO3分子中硫原子杂化方式为sp2,SO3分子空间构型是平面三角形;正确答案:Cu2S; sp2 ; 平面三角形。
(6)设晶体中晶胞边长为lcm;Y的化学式为Fe2O3,单位晶胞中含有两个Fe2O3,所以由![]() =m/v=2
=m/v=2![]() 160/NA
160/NA![]() l3可得,l=
l3可得,l=![]() 2
2![]() 160/NA
160/NA ![]() cm
cm

 通城学典默写能手系列答案
通城学典默写能手系列答案