题目内容
【题目】给盛有氯化钡稀溶液的甲、乙两支试管中分别通入SO2至饱和,若向甲试管中加入足量硝酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是( )
A.甲、乙两试管都有白色沉淀生成
B.甲、乙两试管都没有白色沉淀生成
C.甲试管没有白色沉淀生成而乙试管有
D.甲试管有白色沉淀生成而乙试管没有
【答案】A
【解析】解:SO2和BaCl2不反应,加入硝酸,可将SO2氧化为H2SO4 , 生成BaSO4 , 加入NaOH生成Na2SO3 , 可生成BaSO3沉淀,故选A.

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①固定好滴定管F并使滴定管尖嘴充满液体;
②用蒸馏水洗涤碱式滴定管F,并立即注入NaOH溶液至“0”刻度线以上;
③用标准液滴定至终点,记下滴定管液面读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤调节液面至“0”或“0”刻度线稍下,并记下读数。
请回答:
(1)以上步骤合理的顺序为(填编号)____________________,
(2)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
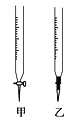

(3)滴定管F中应该选择右图中滴定管_____(填标号)。
(4)错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)
A.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗___________;
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确___________;
C.用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液___________;
D.配制标准溶液的NaOH中混有KOH杂质___________;
(5)滴定操作中,左手_____________,右手______________,眼睛应观察(填编号)_________A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(6)判断滴定终点的现象是:锥形瓶中溶液______________________________;
(7)如下图是某次滴定时的滴定管中的液面,其读数为________mL;
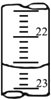
(8)根据下列数据:请计算待测盐酸溶液的浓度:______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |