题目内容
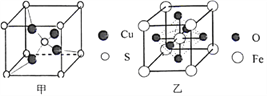
【题目】下列有关焰色反应的叙述中正确的是
A.只有金属的化合物灼烧时才会有不同的焰色
B.每次实验后,铂丝都要用水洗净
C.若透过蓝色钴玻璃只看到紫色,说明样品中含K元素而不含Na元素
D.若样品灼烧呈黄色,判断一定有Na元素,但不能排除含其他金属元素
【答案】D
【解析】
A.焰色反应是元素的性质,单质灼烧也会产生不同的焰色,A错误;
B.每次实验后,铂丝都要用盐酸洗净,B错误;
C.若透过蓝色钴玻璃只看到紫色,说明样品中一定含有K元素不能确定是否含有Na元素,C错误;
D.含有钠元素的物质,灼烧后火焰呈黄色,但不能排除含其它金属元素,故D正确;
答案选D。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】(1)Br位于元素周期表第_____周期第_____族;基态Na+核外有_____种运动状态不同的电子;Mg基态原子核外电子排布式为_____。
(2)用“>”或“<”填空:
第一电离能 | 粒子半径 | 熔点 | 键的极性 |
N_____S | S2—_____ Mg2+ | SO3______Na2O2 | H﹣O_____H﹣N |
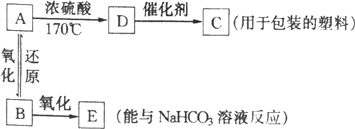
(3)已知多硫化钠﹣溴储能电池是一种二次电池,结构如图。电池总反应为:2Na2S3+2NaBr![]() 3Na2S2+Br2。
3Na2S2+Br2。
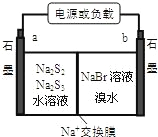
①放电时Na+向_____极迁移(填“a 或 b”);
②充电时阴极电极反应式为:______________。
(4)已知N4为正四面体结构,N﹣N键能为167kJ/mol,N≡N 键能为 942kJ/mol。写 出N4(g)转化为N2(g)的热化学方程式________________。
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①固定好滴定管F并使滴定管尖嘴充满液体;
②用蒸馏水洗涤碱式滴定管F,并立即注入NaOH溶液至“0”刻度线以上;
③用标准液滴定至终点,记下滴定管液面读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤调节液面至“0”或“0”刻度线稍下,并记下读数。
请回答:
(1)以上步骤合理的顺序为(填编号)____________________,
(2)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
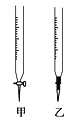

(3)滴定管F中应该选择右图中滴定管_____(填标号)。
(4)错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)
A.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗___________;
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确___________;
C.用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液___________;
D.配制标准溶液的NaOH中混有KOH杂质___________;
(5)滴定操作中,左手_____________,右手______________,眼睛应观察(填编号)_________A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(6)判断滴定终点的现象是:锥形瓶中溶液______________________________;
(7)如下图是某次滴定时的滴定管中的液面,其读数为________mL;
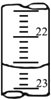
(8)根据下列数据:请计算待测盐酸溶液的浓度:______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
【题目】某同学在研究元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究__________________元素性质递变规律。
(2)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液、酚酞溶液等。
仪器:______、______、滤纸、试管夹、胶头滴管、镊子、小刀、玻璃片、砂纸、火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式及此实验的结论)
实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
实验现象(填A~F) | __ | __ | __ | __ | __ | __ |
①__________________________________________________;
②___________________________________________________;
此实验的结论:__________________________________________________。
【题目】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
Ⅰ.丙烷(C3H8)是一种优良的燃料,下图是一定量丙烷完全燃烧生成CO2和1molH2O(I)过程中的能量变化图。试回答下列问题:
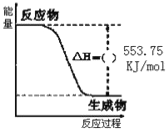
(1)写出丙烷燃烧的热化学方程式:__________。
(2)二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ的热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ的热量,则混合气体中丙烷和二甲醚的物质的量之比为__________。
Ⅱ.用下图所示的装置进行中和热的测定实验,分别取50mL0.55mol/L的NaOH溶液、50mL0.25mol/L的硫酸进行实验,回答下列问题:

(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是__________。
(2)近似认为0.55mol/L的NaOH溶液和0.25mol/L的硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃),通过以下数据计算中和热△H=__________(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)若改用60mL0.25mol/L的H2SO4和50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”或“不相等”)。
(4)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)_____。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.将以上四实验测量温度均纳入计算平均值