题目内容
【题目】某厂废水中含5.00×10-3 mol·L-1的Cr2O![]() ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价有+3,+2),设计了如下实验流程:
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价有+3,+2),设计了如下实验流程:
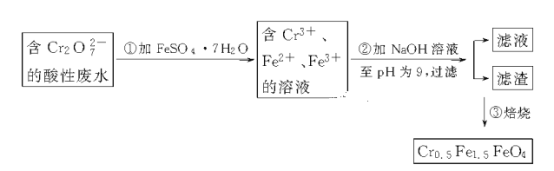
(1)第①步反应的离子方程式是__________________________________________
(2)第②步中用pH试纸测定溶液pH的操作是______________________________
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为______________,加碱调节至pH为________时,铁元素刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为________时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是______________________,原因是________________________________________________。
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
【答案】Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O 将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照 Fe3+ 2.7 6 Zn2+和Fe2+分离不开 Fe(OH)2和Zn(OH)2的Ksp相近
【解析】
(1)第①步主要是重铬酸根和亚铁离子反应生成铬离子和铁离子,其反应的离子方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
(2)第②步中用pH试纸测定溶液pH的操作是将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁在稀硫酸双氧水作用下变为Fe3+,![]() ,c(OH-) = 5×10-12mol·L-1,c(H+) = 2×10-3mol·L-1,pH = 2.7,因此加碱调节至pH为2.7时,铁元素刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱,
,c(OH-) = 5×10-12mol·L-1,c(H+) = 2×10-3mol·L-1,pH = 2.7,因此加碱调节至pH为2.7时,铁元素刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱,![]() ,c(OH-) = 1×10-8mol·L-1,c(H+) =1×10-6mol·L-1,pH = 6,因此pH为6时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近,不能分离开。
,c(OH-) = 1×10-8mol·L-1,c(H+) =1×10-6mol·L-1,pH = 6,因此pH为6时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近,不能分离开。
(1)第①步主要是重铬酸根和亚铁离子反应生成铬离子和铁离子,其反应的离子方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
(2)第②步中用pH试纸测定溶液pH的操作是将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照,故答案为:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁在稀硫酸双氧水作用下变为Fe3+,![]() ,c(OH-) = 5×10-12mol·L-1,c(H+) = 2×10-3mol·L-1,pH = 2.7,因此加碱调节至pH为2.7时,铁元素刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱,
,c(OH-) = 5×10-12mol·L-1,c(H+) = 2×10-3mol·L-1,pH = 2.7,因此加碱调节至pH为2.7时,铁元素刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱,![]() ,c(OH-) = 1×10-8mol·L-1,c(H+) =1×10-6mol·L-1,pH = 6,因此pH为6时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近,不能分离开,故答案为:Fe3+; 2.7;6;Zn2+和Fe2+分离不开;Fe(OH)2和Zn(OH)2的Ksp相近。
,c(OH-) = 1×10-8mol·L-1,c(H+) =1×10-6mol·L-1,pH = 6,因此pH为6时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近,不能分离开,故答案为:Fe3+; 2.7;6;Zn2+和Fe2+分离不开;Fe(OH)2和Zn(OH)2的Ksp相近。