题目内容
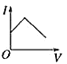
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.A物质与C物质的反应速率之比为1∶2
B.单位时间内消耗a mol A,同时消耗3a mol C
C.容器内的压强不再变化
D.混合气体的物质的量不再变化
【答案】B
【解析】
A.必须表示出A物质与C物质的反应速率方向相反,且速率比等于化学计量数之比,故此判据不能判定反应是否达到平衡状态,故A错误;
B.单位时间内消耗a molA,会生成3amolC,同时消耗3a mol C,正逆反应速率相等,达到了平衡状态,故B正确;
C.两边气体的计量数相等,所以容器的压强始终不变,不能作平衡状态的标志,故C错误;
D.该反应的反应前后气体计量数之和不变,所以无论该反应是否达到平衡状态,混合气体的物质的量始终不变,所以不能据此判断平衡状态,故D错误;
故答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)已知常温时,a mol/L醋酸与0.1mol/LNaOH溶液等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=___________ (用含a的代数式表示)
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
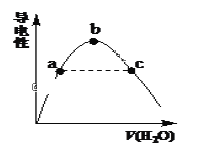
①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
②a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-)_____c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是_____(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:________