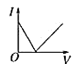题目内容
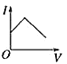
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,对于反应2SiHCl3(g)![]() SiH2Cl2(g) +SiCl4(g),应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法错误的是( )
SiH2Cl2(g) +SiCl4(g),应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法错误的是( )

A.该反应的正反应活化能大于逆反应活化能
B.a、b处反应速率大小:va大于vb
C.温度一定时使用更优质催化剂,可使k正、k逆增大,k正与k逆的比值增大
D.343K时反应的平衡常数K=![]()
【答案】C
【解析】
根据达到平衡所需时间可知a所在曲线的温度更高,故a所在曲线的温度为343K,b所在曲线的温度为323K,进一步分析可知温度越高SiHCl3的转化率越高,即温度升高平衡右移,正反应吸热,![]() >0;
>0;
A. 根据分析可知![]() =正反应活化能-逆反应活化能>0,故A正确;
=正反应活化能-逆反应活化能>0,故A正确;
B.根据分析可知a点温度高于b点,温度越高反应速率越快,故B正确;
C. v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,反应达到平衡时正逆反应速率相等,即k正x2SiHCl3= k逆xSiH2Cl2xSiCl4,经变换可得平衡常数K=k正/k逆,即温度不变k正与k逆的比值不变,故C错误;
D. 由图示可知343K时反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)的平衡转化率α=22%,设SiHCl3的起始浓度为cmol/L,则
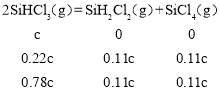
平衡常数![]() =
=![]() ;故D正确;
;故D正确;
故答案为C。

【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理] 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
[实验内容及记录]
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=_____________________________。
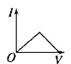
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设。并继续进行实验探究。
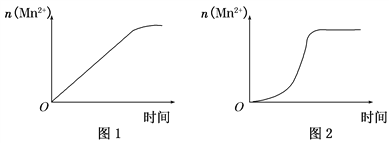
①该小组同学提出的假设是____________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | ________ | t |
③若该小组同学提出的假设成立,应观察到的现象是_________________________。