题目内容
【题目】(1)工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g) ===CH3OH(g) ΔH=-90.8 kJ·mol-1。在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。
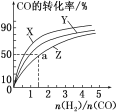
如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是__________。
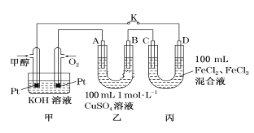
(2)如图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
Ⅰ.甲中负极的电极反应式为__________________________。
Ⅱ.乙中反应的化学方程式为_________________________________;A极析出的气体在标准状况下的体积为________。
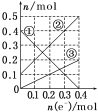
Ⅲ.丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则图中②线表示的是________的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要______ mL 5.0 mol·L-1 NaOH溶液。
【答案】270 ℃ Ⅰ.CH3OH-6e-+8OH-===![]() +6H2O 2CuSO4+2H2O===2Cu+O2↑+2H2SO4,2H2O===O2↑+2H2↑ 2.24 L Fe2+ 280
+6H2O 2CuSO4+2H2O===2Cu+O2↑+2H2SO4,2H2O===O2↑+2H2↑ 2.24 L Fe2+ 280
【解析】
(1)该反应是放热反应,升高温度,平衡逆向移动,转化率减小,因此Z为270 ℃。
(2)Ⅰ.甲中燃料为负极,氧化剂为正极,因此甲醇为负极,在碱性条件下失去电子变为碳酸根和水,因此负极的电极反应式为CH3OH-6e-+8OH-= CO32-+6H2O。
Ⅱ.乙中是先电解硫酸铜溶液,后来再电解水的反应,其化学方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() O2↑+2H2↑;乙中有硫酸铜物质的量为0.1mol,A为阳极,生成氧气,B为阴极,先生成铜单质,再生成氢气,A、B产生的气体相等,因此根据电子守恒关系,A产生了xmol氧气,4xmol = 0.1mol×2 + 2xmol,解得x = 0.1mol,V = nVm = 0.1mol×22.4Lmol-1=2.24L。
O2↑+2H2↑;乙中有硫酸铜物质的量为0.1mol,A为阳极,生成氧气,B为阴极,先生成铜单质,再生成氢气,A、B产生的气体相等,因此根据电子守恒关系,A产生了xmol氧气,4xmol = 0.1mol×2 + 2xmol,解得x = 0.1mol,V = nVm = 0.1mol×22.4Lmol-1=2.24L。
Ⅲ.丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,阳极为铜,铜失去电子变为铜离子,因此①为铜离子,阴极为铁离子得到电子变为亚铁离子,因此③为铁离子减少,②为亚铁离子增加图像,因此图中②线表示的是Fe2+的变化;根据图像得出铜离子物质的量为0.2mol,亚铁离子物质的量为0.5mol,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,则需要NaOH物质的量为0.2mol×2 + 0.5mol×2 = 1.4mol,则需要5.0 mol·L-1 NaOH溶液![]() 。
。
(1)该反应是放热反应,升高温度,平衡逆向移动,转化率减小,因此Z为270 ℃,故答案为:270 ℃。
(2)Ⅰ.甲中燃料为负极,氧化剂为正极,因此甲醇为负极,在碱性条件下失去电子变为碳酸根和水,因此负极的电极反应式为CH3OH-6e-+8OH-= CO32-+6H2O,故答案为:CH3OH-6e-+8OH-= CO32-+6H2O。
Ⅱ.乙中是先电解硫酸铜溶液,后来再电解水的反应,其化学方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() O2↑+2H2↑;乙中有硫酸铜物质的量为0.1mol,A为阳极,生成氧气,B为阴极,先生成铜单质,再生成氢气,A、B产生的气体相等,因此根据电子守恒关系,A产生了xmol氧气,4xmol = 0.1mol×2 + 2xmol,解得x = 0.1mol,V = nVm = 0.1mol×22.4Lmol-1=2.24L,故答案为:2.24L。
O2↑+2H2↑;乙中有硫酸铜物质的量为0.1mol,A为阳极,生成氧气,B为阴极,先生成铜单质,再生成氢气,A、B产生的气体相等,因此根据电子守恒关系,A产生了xmol氧气,4xmol = 0.1mol×2 + 2xmol,解得x = 0.1mol,V = nVm = 0.1mol×22.4Lmol-1=2.24L,故答案为:2.24L。
Ⅲ.丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,阳极为铜,铜失去电子变为铜离子,因此①为铜离子,阴极为铁离子得到电子变为亚铁离子,因此③为铁离子减少,②为亚铁离子增加图像,因此图中②线表示的是Fe2+的变化;根据图像得出铜离子物质的量为0.2mol,亚铁离子物质的量为0.5mol,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,则需要NaOH物质的量为0.2mol×2 + 0.5mol×2 = 1.4mol,则需要5.0 mol·L-1 NaOH溶液![]() ,故答案为:280。
,故答案为:280。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论错误的有( )
序号 | 规律 | 结论 |
① | 活泼金属的氧化物为碱性氧化物 |
|
② | 酸与酸性氧化物不能发生反应 | 氢氟酸可以储存在玻璃试剂瓶中 |
③ | 较弱酸不能制取较强酸 | 氢硫酸不能制取硫酸 |
④ | 复分解反应均不是氧化还原反应 | 酸碱中和反应中没有电子的转移 |
A.①②③B.②③④C.①③④D.①②④