题目内容
10.络氨铜[Cu(NH3)4]SO4是一种重要的染料及农药中间体.已知:①以氧化铜为主要原料合成该物质的合成路线如图1: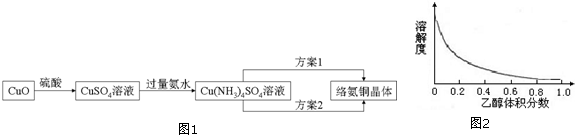
②络氨铜在乙醇-水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图2.
③(NH4)2SO4在水中可溶,在乙醇中难溶.
请根据以上信息回答下列问题:
(1)由CuO制出的CuSO4溶液中常含有 Fe2(SO4)3杂质,请设计一个可行方案,检验CuSO4溶液中是否含有Fe3+:取适量溶液,滴加KSCN溶液,如果溶液变红,说明含有Fe3+,反之则无.
(2)[Cu(NH3)4]SO4 在水中存在如下解离过程:[Cu(NH3)4]SO4═[Cu(NH3)4]2+(深蓝色离子)+SO42-;[Cu(NH3)4]2+?Cu2++4NH3.请写出在CuSO4溶液中逐滴加入氨水至过量的反应现象:随着氨水的滴入,产生蓝色絮状沉淀;氨水过量后,蓝色沉淀又溶解,溶液变深蓝色.
(3)①方案1的实验步骤为:加热蒸发→冷却结晶→过滤洗涤→干燥.该方案存在明显缺陷,因为得到的产物晶体往往含有Cu2(OH)2SO4杂质,产生该杂质的原因是加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+?Cu2++4NH3平衡往右移动,且Cu2+发生水解.
②方案2是较为理想的结晶方案,先向溶液C加入适量无水乙醇(填物质名称),再过滤、洗涤、干燥即可得到较纯净的晶体.下列选项中,最适合作为滤出晶体洗涤液的是C.
A.乙醇 B. 蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤沉淀的操作方法是用胶头滴管吸收少量乙醇溶液滴在固体上至浸没固体,待洗液滤出后,重复2~3次.
(4)氨含量的测定:准确称取a g络氨铜样品,加入过量NaOH溶液微热,使NH3充分释放,并被准确量取的30.00mL 0.5000mol.L-1HCl溶液充分吸收.吸收液用0.1200mol•L-1的NaOH溶液滴定,消耗的NaOH溶液的体积为VL,则络氨铜样品中氨的质量分数为$\frac{17(0.015-0.12V)}{a}$(用含a、V的字母表达).
分析 (1)Fe3+遇KSCN溶液变血红色,据此检验Fe3+;
(2)CuSO4溶液中逐滴加入氨水先生成氢氧化铜,再加过量的氨水氨水与氢氧化铜生成铜氨络离子;
(3)①加热时氨气易挥发,使平衡-[Cu(NH3)4]2+?Cu2++4NH3.向正反应方向移动,且加热时,Cu2+水解程度变大;
②根据题中图2可知,溶液中乙醇含量越高,络氨铜在乙醇-水混合溶剂中的溶解度越小,洗涤时既要能除去固体表面可溶的杂质杂质,又要尽可能减少晶体因溶解而损失,据此选择试剂;
(4)氨含量的测定过程中,根据0.1200mol•L-1的NaOH溶液VL,计算出与之反应的盐酸,再根据盐酸的总量为30.00mL×0.5000mol.L-1=0.015mol可计算得与氨气反应的盐酸,并由此计算出样品中的氨的质量,根据络氨铜样品中氨的质量分数=$\frac{氨的质量}{样品质量}$×100%计算;
解答 解:(1)Fe3+遇KSCN溶液变血红色,所以检验CuSO4溶液中是否含有Fe3+的方法为取适量溶液,滴加KSCN溶液,如果溶液变红,说明含有Fe3+,反之则无,
故答案为:取适量溶液,滴加KSCN溶液,如果溶液变红,说明含有Fe3+,反之则无;
(2)CuSO4溶液中逐滴加入氨水先生成氢氧化铜,再加过量的氨水氨水与氢氧化铜生成铜氨络离子,所以反应现象为随着氨水的滴入,产生蓝色絮状沉淀;氨水过量后,蓝色沉淀又溶解,溶液变深蓝色,
故答案为:随着氨水的滴入,产生蓝色絮状沉淀;氨水过量后,蓝色沉淀又溶解,溶液变深蓝色;
(3)①加热时氨气易挥发,使平衡-[Cu(NH3)4]2+?Cu2++4NH3向正反应方向移动,且加热时,Cu2+水解程度变大,导致晶体中有Cu2(OH)2SO4杂质,
故答案为:加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+?Cu2++4NH3平衡往右移动,且Cu2+发生水解;
②根据题中图2可知,溶液中乙醇含量越高,络氨铜在乙醇-水混合溶剂中的溶解度越小,所以要从络氨铜溶液中析出络氨铜晶体,向溶液中加入无水乙醇,洗涤时既要能除去固体表面可溶的杂质杂质,又要尽可能减少晶体因溶解而损失,所以洗涤络氨铜晶体用乙醇和水的混合液,故选C,洗涤时用用胶头滴管吸收少量乙醇溶液滴在固体上至浸没固体,待洗液滤出后,重复2~3次,
故答案为:无水乙醇;C;用胶头滴管吸收少量乙醇溶液滴在固体上至浸没固体,待洗液滤出后,重复2~3次;
(4)0.1200mol•L-1的NaOH溶液VL,可以中和掉的盐酸的物质的量为0.12Vmol,溶液中盐酸的总量为30.00mL×0.5000mol.L-1=0.015mol,所以与氨气反应的盐酸的物质的量为0.015mol-0.12Vmol,所以样品中的氨的质量为(0.015-0.12V)×17g,所以络氨铜样品中氨的质量分数为$\frac{(0.015-0.12V)×17g}{ag}$=$\frac{17(0.015-0.12V)}{a}$,
故答案为:$\frac{17(0.015-0.12V)}{a}$.
点评 本题考查物质的制备,涉及化学平衡移动、结晶方式的分析、化学计算等,弄清实验原理、目的、要求、步骤和注意事项是解题的关键,中等难度.

 名校课堂系列答案
名校课堂系列答案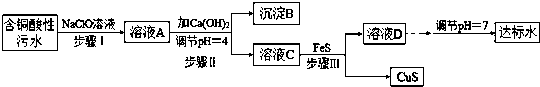
相关信息:
①含铜酸性污水主要污染物离子(见表-1)
表-1
| 离子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 浓度/(mol/L) | 0.1 | 0.05 | 0.04 | 0.002 |
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp) (见表-2)
表-2
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Kw | 4.0×10-38 | 8.0×10-16 | 2.2×10-20 | 6.4×10-13 | 6.0×10-36 |
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤II中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤II中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=2.2×10-20÷(10-7)2=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤III中所发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).
| A. | 气态氢化物的稳定性:Y>X>W | |
| B. | 四种元素的原子中W原子半径最大 | |
| C. | 四种元素中最高价氧化物的水化物酸性Y最强 | |
| D. | 化合物XY2与ZY2分子中的化学键类型相同 |
| A. | 把SO2通入酸性高锰酸钾溶液,即可验证SO2的漂白性 | |
| B. | 无论是在0.1mol•L-1的CH3COOH溶液中加水稀释,还是加入少量CH3COONa晶体,都会引起溶液的导电能力减弱 | |
| C. | 实验室需用480mL 0.1mol•L-1硫酸铜溶液,应称取12.5g胆矾晶体,并用500mL容量瓶定容配制 | |
| D. | 硫酸亚铁铵晶体中NH4+的检验操作为:取适量样品置于试管中加水溶解,滴加少量稀氢氧化钠溶液,并将湿润的红色石蕊试纸靠近试管口,试纸变蓝则存在NH4+,反之则不存在NH4+ |
| A. | NH${\;}_{4}^{+}$、Cu2+、Cl-、NO${\;}_{4}^{2-}$ | B. | K+、Na+、CO${\;}_{3}^{2-}$、S2- | ||
| C. | K+、Na+、CH3COO-、SO${\;}_{4}^{2-}$ | D. | Ba2+、Mg2+、HCO${\;}_{3}^{-}$、Cl- |
 将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,使合金全部溶解.向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液体积的关系如图曲线所示.则盐酸的物质的量浓度为( )
将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,使合金全部溶解.向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液体积的关系如图曲线所示.则盐酸的物质的量浓度为( )| A. | 1mol/L | B. | 8mol/L | C. | 10mol/L | D. | 12mol/L |



