题目内容
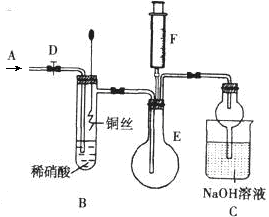
化学实验有助于理解化学知识,提升科学素养。某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究。
(1)已知发生装置如图所示。制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸。
(2)该小组关于实验中可制得氯气体积(标准状况)的讨论正确的是
A.若提供0.4 mol HCl,MnO2不足量,则可制得氯气2.24 L
B.若提供0.4 mol HCl,MnO2过量,则可制得氯气2.24 L
C.若有0.4 mol HCl参与反应,则可制得氯气2.24 L
D.若有0.4 mol HCl被氧化,则可制得氯气2.24 L
(3)将Cl2通入水中,所得溶液中具有氧化性的含氯粒子有________ (填微粒符号)
(4)下列收集Cl2的正确装置是________。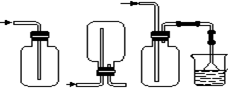
A B C D
(5)该小组利用刚吸收过少量SO2的NaOH溶液对Cl2进行尾气处理。
①请完成吸收初期的化学方程式:Cl2+Na2SO3+2 NaOH= ________________
②吸收一段时间后,某同学取出2mL吸收后的溶液(强碱性)于试管中,充分振荡后向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,随即又褪去。溶液先变蓝,说明吸收后的溶液中存在 (填微粒符号),用离子方程式表示蓝色褪去的可能原因: 。
(1)A C B (2)C (3)Cl2、ClO- 、 HClO (4)C
(5)①2NaCl+Na2SO4+H2O ②ClO- ; I2+2OH-=I-+IO-+H2O
解析试题分析:(1)在实验室制取Cl2时首先应该检查装置的气密性。然后再往烧瓶中加入MnO2粉末;接着往烧瓶中加入浓盐酸最后加热;顺序是A.C.B。发生反应为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。A.若提供0.4 mol HCl,MnO2不足量,应该以不足量的物质为标准,但是MnO2的量不定,因此产生的氯气在标准状况下的体积一定小于2.24 L。错误。 B.若提供0.4 mol HCl,MnO2过量,则可制得氯气2.24 L则如果0.4 mol HCl完全反应,可制得氯气2.24 L。但是随着反应的进行,盐酸变为稀盐酸,这时反应就不再发生。因此制得氯气在标准状况下的体积就小于2.24 L。错误。C.根据方程式可以看出:每有4mol的盐酸发生反应,产生标准状况下的氯气的体积为22.4L。因此若有0.4 mol HCl参与反应,则可制得氯气2.24 L。正确。D.由方程式可以看出:每有4mol的盐酸发生反应,则有2mol的盐酸贝氧化,得到氯气为1mol。因此若有0.4 mol HCl被氧化,则可制得标准状况下的氯气4.48 L.错误。(3)将Cl2通入水中,发生反应:Cl2+H2O
MnCl2+Cl2↑+2H2O。A.若提供0.4 mol HCl,MnO2不足量,应该以不足量的物质为标准,但是MnO2的量不定,因此产生的氯气在标准状况下的体积一定小于2.24 L。错误。 B.若提供0.4 mol HCl,MnO2过量,则可制得氯气2.24 L则如果0.4 mol HCl完全反应,可制得氯气2.24 L。但是随着反应的进行,盐酸变为稀盐酸,这时反应就不再发生。因此制得氯气在标准状况下的体积就小于2.24 L。错误。C.根据方程式可以看出:每有4mol的盐酸发生反应,产生标准状况下的氯气的体积为22.4L。因此若有0.4 mol HCl参与反应,则可制得氯气2.24 L。正确。D.由方程式可以看出:每有4mol的盐酸发生反应,则有2mol的盐酸贝氧化,得到氯气为1mol。因此若有0.4 mol HCl被氧化,则可制得标准状况下的氯气4.48 L.错误。(3)将Cl2通入水中,发生反应:Cl2+H2O H++Cl-+HClO。HClO是弱酸,在溶液中存在电离平衡:HClO
H++Cl-+HClO。HClO是弱酸,在溶液中存在电离平衡:HClO H++ClO-.在所得溶液中具有氧化性的含氯粒子有Cl2、ClO-、HClO。(4)A只有入气管,而没有出气管。错误。B.Cl2的密度比空气大,要用向上排空气法收集。错误。C.是用用向上排空气法收集,由于Cl2是大气污染物,所以在排放之前进行了尾气的吸收和处理。正确。D不能收集气体。氯气被处理吸收。错误。选项为C。(5)①Cl2有氧化性,Na2SO3有还原性,二者发生反应的化学方程式:Cl2+Na2SO3+2 NaOH=2NaCl+Na2SO4+H2O。②吸收一段时间后,向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,是因为溶液中发生了反应:Cl2+2OH-=Cl-+ClO-+H2O。ClO-有强氧化性,能把I-氧化为I2。I2遇淀粉变为蓝色。随即又褪去,是因为又发生了反应:I2+2OH-=I-+IO-+H2O。
H++ClO-.在所得溶液中具有氧化性的含氯粒子有Cl2、ClO-、HClO。(4)A只有入气管,而没有出气管。错误。B.Cl2的密度比空气大,要用向上排空气法收集。错误。C.是用用向上排空气法收集,由于Cl2是大气污染物,所以在排放之前进行了尾气的吸收和处理。正确。D不能收集气体。氯气被处理吸收。错误。选项为C。(5)①Cl2有氧化性,Na2SO3有还原性,二者发生反应的化学方程式:Cl2+Na2SO3+2 NaOH=2NaCl+Na2SO4+H2O。②吸收一段时间后,向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,是因为溶液中发生了反应:Cl2+2OH-=Cl-+ClO-+H2O。ClO-有强氧化性,能把I-氧化为I2。I2遇淀粉变为蓝色。随即又褪去,是因为又发生了反应:I2+2OH-=I-+IO-+H2O。
考点:考查Cl2的实验室制取原理、步骤、性质现象、化学方程式、离子方程式的书写及相应的计算的知识。

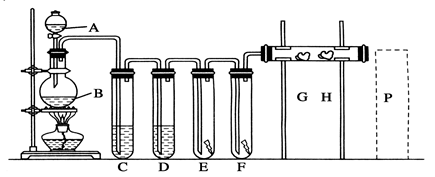
某化学兴趣小组在实验室探究氨的有关性质,设计了下图所示实验,A处是气体发生装置,A中所用的实验药品从下列物质中选取.
①碳酸钠 ②碳酸氢钠 ③碳酸氢铵 ④氯化铵 ⑤熟石灰 ⑥氢氧化钠
按上图连接好各仪器,现将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯,部分实验的现象如下:铂丝继续保持红热状态,D中的铜片慢慢溶解,回答下列问题:
(1)若A中制取气体时只用了一种药品,则该药品是 (填物质序号)
(2)B装置的作用为
(3)D中铜片发生反应的离子方程式为 ,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的 (填下列各项序号)
| A.Na2CO3 | B.AgNO3 | C.H2SO4 | D.FeSO4 |
(5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进,谈谈你的意见: 。