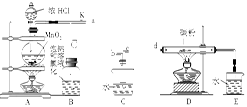题目内容
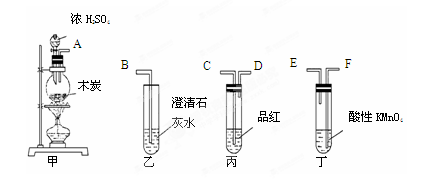
某研究性学习小组设计两套实验方案制备氨气并探究其还原性(部分夹持装置已省略)。
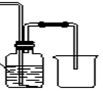
甲方案:如图所示。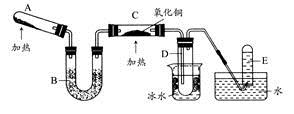
乙方案:如图所示。
根据方案回答下列问题:
(一)甲方案
(1)B装置盛装碱石灰,A装置中药品可以是 。
a.氯化铵固体和烧碱 b.碳酸氢铵固体
c.氯化铵固体 d.硫酸铵和熟石灰
(2)实验完毕后,设计简单实验检验D试管收集到的物质(简述操作过程、现象和结论) 。
(3)写出C中发生反应的化学方程式 。
(二)乙方案
(4)A为浓氨水,B为生石灰,简述实验原理: 。E装置里盛装的药品是 。
(5)能证明氨气具有还原性的实验现象 。(任写两条)
(6)铜有+2价、+1价、0价,根据氧化还原反应原理,D玻璃管里还原产物除铜外,还可能有 ,假设有铜以外的还原产物生成,写出D中发生反应的化学方程式: 。
(1)bd (2)用玻璃棒蘸取D中液体滴在红色石蕊试纸上,试纸变蓝,证明D中收集的是氨水 (3)3CuO+2NH3 N2+3Cu+3H2O (4)生石灰溶于水放出大量的热,氨气在水中的溶解度随温度的升高而减小,生石灰与水反应,消耗水,减少了氨水中的溶剂,故生石灰与浓氨水混合产生大量氨气;无水硫酸铜 (5)D玻璃管中的黑色粉末变成红色,玻璃管壁有水珠;E中无水硫酸铜粉末由白色变为蓝色;F中收集到一定量气体等 (6)Cu2O;4CuO+2NH3=Cu2O+2Cu+N2+3H2O
N2+3Cu+3H2O (4)生石灰溶于水放出大量的热,氨气在水中的溶解度随温度的升高而减小,生石灰与水反应,消耗水,减少了氨水中的溶剂,故生石灰与浓氨水混合产生大量氨气;无水硫酸铜 (5)D玻璃管中的黑色粉末变成红色,玻璃管壁有水珠;E中无水硫酸铜粉末由白色变为蓝色;F中收集到一定量气体等 (6)Cu2O;4CuO+2NH3=Cu2O+2Cu+N2+3H2O
解析

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案S2C12是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组拟设计实验制备少量的S2C12,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化合价升高,另一部分化合价降低)。加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2C12,反应的化学方程式为:2S+Cl2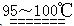 S2Cl2。
S2Cl2。
反应涉及的几种物质的熔沸点如下:
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
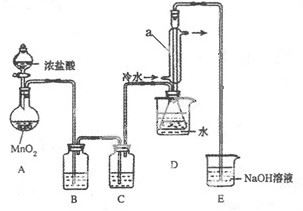
回答下列问题:
(1)连接好实验装置后的第一步实验操作是______。
(2)实验中需要加热的仪器是 (填写字母)
(3)装置B、C中的试剂分别是 。
(4)装置D中仪器a的作用是 。
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是____________。
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因____________。
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气体产生。用离子方程式表示产生该现象的原因____________。
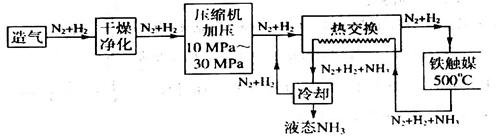
(16分)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示。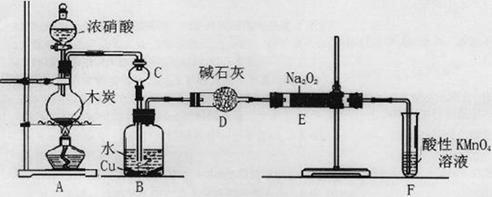
已知:室温下,① 2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,5NO2— + 2MnO4—+ 6H+=5NO3—+ 2Mn2++ 3H2O。
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有____________________,_____________________。
(3)装置C的作用:____________________,装置F的作用:___________________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物________________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
| A.自来水 | B.碘化钾淀粉试液 | C.淀粉 | D.白糖 E.食醋 F.白酒 |
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发现的有关问题。
Ⅰ.探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的浓硫酸、稀硫酸、浓硝酸、稀硝酸,实验结果记录如下表:
| | 酸 | 实验结果 |
| a | 浓硫酸 | 加热后发生反应,产生无色刺激性气体 |
| b | 稀硫酸 | 加热也不发生反应 |
| c | 浓硝酸 | 不加热即发生反应,产生红棕色气体 |
| d | 稀硝酸 | 微热发生反应,产生无色气体 |
①由上表中实验结果,四种酸的氧化性由强到弱的顺序是 。
②由上表可知,铜与稀硫酸在加热条件下不反应,但若同时通入O2,铜片能逐渐溶解,溶液变为蓝色。写出该反应的化学方程式: 。
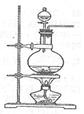
(2)先将铜与浓硫酸反应产生的气体X持续通入如图所示装置中,一段时间后再将铜与浓硝酸产生的气体Y也持续通入该装置中,则整个过程中可观察到的现象包括 (填字母)。

A.通入X气体后产生白色沉淀
B.通入X气体后溶液无明显现象
C.通入Y气体后产生沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是 (填字母)。
A.硝酸的酸性比硫酸强
B.H2SO3的酸性比盐酸强
C.HNO3能氧化H2SO3(或SO2)
D.BaSO4既不溶于水也不溶于HNO3溶液
Ⅱ.如图是某同学探究铜与稀硝酸反应的还原产物的实验装置图,请回答下列问题:

(1)写出铜与稀硝酸反应的离子方程式: 。
(2)已知装置气密性良好,请简述利用该装置证明铜与稀硝酸反应生成的气体产物是NO的操作过程: 。
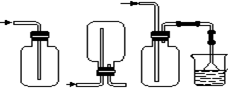
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题: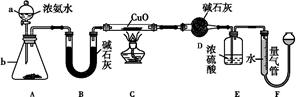
(1)仪器a的名称为 ;仪器b中可选择的试剂为 。
(2)实验室中,利用装置A,还可制取的无色气体是 (填字母)。
| A.Cl2 | B.O2 | C.CO2 | D.NO2 |
(4)E装置中浓硫酸的作用是 。
(5)读取气体体积前,应对装置F进行的操作: 。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为 (用含m、n字母的代数式表示)。