��Ŀ����
����Ŀ��T��ʱ�����ݻ�Ϊ0.5 L���ܱ������з���ijһ��Ӧ���Ҳ�ò�ͬʱ����������������A��B��C��D�����ʵ����仯����ͼ��ʾ.��֪������A��B��C��Ϊ��̬��DΪ��̬������Ӧ�����ȷ�Ӧ��
����Ҫ��ش��������⣺

��1�������з�Ӧ�Ļ�ѧ����ʽΪ_________________________________.
��2��ǰ2 min��v(A)��___________mol/(L��min)
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����_________������ĸ����ͬ��.
A����������ѹǿ���� B�����������ܶȲ���
C������0.1 mol Bͬʱ����0.1 mol D D��B�����ʵ�������
��4����Ӧ�ﵽƽ��ı����д�ʩ��ʹA��ת�����������________.
A��ֻ����A�����ʵ��� B������һ����D
C�����߷�Ӧ��ϵ���¶� D���������������Сһ��
��5���ϳɼ״�����Ҫ��ӦΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H<0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���ʾ��
CH3OH(g) ��H<0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���ʾ��
T/�� | T1 | T2 | T3 |
K | 1/1000 | 1/40 | 25 |
T1��T2��T3�Ĵ�С��ϵΪ__________________________
���𰸡� 2A��B![]() 3C��D 0.4 BD C T1>T2>T3
3C��D 0.4 BD C T1>T2>T3
�������������������1����ͼ����A��B���ʵ�����С��C��D���ʵ������ӣ�����A��B�Ƿ�Ӧ�C��D���������Ӧ��2minʱ���ʵ������ٸı䣬˵���ǿ��淴Ӧ����Ӧ��A������0.4mol��B������0.2mol��C������0.6mol��D������0.2mol����Ӧ���ʵı仯��֮�ȵ��ڻ�ѧ������֮�ȣ���2������![]() �������ʣ���3�����ݻ�ѧƽ���������������4�����ݸı�������ƽ���ƶ������������5��CO(g)+2H2(g)
�������ʣ���3�����ݻ�ѧƽ���������������4�����ݸı�������ƽ���ƶ������������5��CO(g)+2H2(g)![]() CH3OH(g) ��H<0������Ӧ���ȣ������¶�ƽ�������ƶ���
CH3OH(g) ��H<0������Ӧ���ȣ������¶�ƽ�������ƶ���
��������1����ͼ����A��B���ʵ�����С��C��D���ʵ������ӣ�����A��B�Ƿ�Ӧ�C��D���������Ӧ��2minʱ���ʵ������ٸı䣬˵���ǿ��淴Ӧ����Ӧ��A������0.4mol��B������0.2mol��C������0.6mol��D������0.2mol����Ӧ���ʵı仯��֮�ȵ��ڻ�ѧ������֮�ȣ����Է�Ӧ����ʽ��2A��B![]() 3C��D����2��ǰ2min����c(A)=0.4mol��0.5L=0.8mol/L, v(A)��0.8mol/L��2min=0.4mol/(L��min)����3��A��B��C��Ϊ��̬��DΪ��̬����Ӧ���������ʵ�������ķ�Ӧ�������Ƿ�ﵽƽ�⣬ѹǿ����ı䣬ѹǿ���䲻��˵������Ӧ�ﵽ��ƽ�⣬��A����Ӧ��ϵ����������壬��Ӧ������������DZ���������������ܶ�Ҳ��ı䣬������ܶȲ���˵����������ɺ�����������ȣ���Ӧ�ﵽ��ƽ�⣬��B��ȷ��B�Ƿ�Ӧ�D������������Ƿ�ﵽƽ�⣬����0.1mol��Bͬʱ����0.1mol��D����C����B�����ʵ�������˵��B�����ɺ�����������ȣ���Ӧ�ﵽ��ƽ�⣬��D��ȷ��ѡBD����4������ A������B��ת��������A��ת���ʼ��ͣ���A����D�ǹ��壬����D�����ʵ�Ũ��û��Ӱ�죬ƽ�ⲻ�����ƶ�����B����Ӧ�����ȷ�Ӧ�������¶�ƽ���������ƶ���A��ת��������C��ȷ���������������Сһ�����൱������ѹǿ��ƽ�ⲻ�ƶ���A��ת���ʲ��䣬��D����ѡC����5��CO(g)+2H2(g)
3C��D����2��ǰ2min����c(A)=0.4mol��0.5L=0.8mol/L, v(A)��0.8mol/L��2min=0.4mol/(L��min)����3��A��B��C��Ϊ��̬��DΪ��̬����Ӧ���������ʵ�������ķ�Ӧ�������Ƿ�ﵽƽ�⣬ѹǿ����ı䣬ѹǿ���䲻��˵������Ӧ�ﵽ��ƽ�⣬��A����Ӧ��ϵ����������壬��Ӧ������������DZ���������������ܶ�Ҳ��ı䣬������ܶȲ���˵����������ɺ�����������ȣ���Ӧ�ﵽ��ƽ�⣬��B��ȷ��B�Ƿ�Ӧ�D������������Ƿ�ﵽƽ�⣬����0.1mol��Bͬʱ����0.1mol��D����C����B�����ʵ�������˵��B�����ɺ�����������ȣ���Ӧ�ﵽ��ƽ�⣬��D��ȷ��ѡBD����4������ A������B��ת��������A��ת���ʼ��ͣ���A����D�ǹ��壬����D�����ʵ�Ũ��û��Ӱ�죬ƽ�ⲻ�����ƶ�����B����Ӧ�����ȷ�Ӧ�������¶�ƽ���������ƶ���A��ת��������C��ȷ���������������Сһ�����൱������ѹǿ��ƽ�ⲻ�ƶ���A��ת���ʲ��䣬��D����ѡC����5��CO(g)+2H2(g)![]() CH3OH(g) ��H<0������Ӧ���ȣ������¶�ƽ�������ƶ���ƽ�ⳣ����С���¶�Խ��ƽ�ⳣ��ԽС������T1>T2>T3��
CH3OH(g) ��H<0������Ӧ���ȣ������¶�ƽ�������ƶ���ƽ�ⳣ����С���¶�Խ��ƽ�ⳣ��ԽС������T1>T2>T3��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ij����FeSO3��Һ�к���������SnSO4 �� Ϊ�õ������������������壨FeSO4xH2O����������Һ��ͨ��H2S���������ͣ�Ȼ���������ữ��pH=2�����˺�������Һ����Ũ������ȴ�ᾧ������ϴ�ӣ��õ������������壮�������ϣ��õ�������ʵ��й��������±���
25�� | pH | 25�� | pH |
����H2S��Һ | 3.9 | FeS��ʼ���� | 3.0 |
SnS������ȫ | 1.6 | FeS������ȫ | 5.5 |
��1��������������������FeSO4��Һʱ�������������� ��
��2��Ϊ�����Ƶõ����������������Ƿ���Fe3+ �� ��ѡ�õ��Լ�Ϊ ��
A.KSCN��Һ
B.ϡ����
C.���۩�KI��Һ
D.KMnO4��Һ
��3��ͨ��H2S���������͵�Ŀ�������������ữ��pH=2��Ŀ���� ��
��4��Ϊ�о���������������ȷֽ⣬ij��ȤС��ͬѧ��ȡag��������������Ʒ����ͼ1װ�ý��и��¼��ȣ�ʹ����ȫ�ֽ⣨�������������ڸ��������»طֽ�Ϊ���ֻ������һ�ֵ��ʣ��õ�����ʹ�����ǵ�ľ����ȼ���������ò������̽������ͨ������װ��B���������x��ֵ��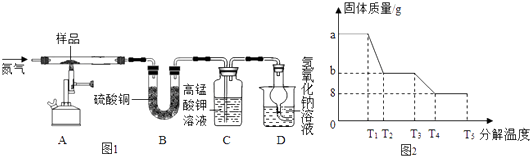
��װ��B����ˮ����ͭ��ĩ��������������12.6g��˵����������ˮ��װ��C�и��������Һ��ɫ��˵�������к��� ��
��ʵ����Ҫ����ͨ�뵪������������x�����ƫ�ڡ�����ƫ�ڡ����䡱����
����������������ȫ�ֽ��װ��A�й���ʺ���ɫ�������������ϡ�����У�����ȫ���ܽ⣬�û�ɫ��Һ��
��ij�о�������SDTQ600�ȷ����Ƕ�����������������ȷֽ⣬���������ݣ����ƳɵĹ���������ֽ��¶ȵĹ�ϵͼ��ͼ2������ͼ���й����ݣ��ɼ����xΪ ��