题目内容
【题目】将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL溶液,再缓慢通入HCl气体6.72L(标准状况),若反应过程中溶液的体积保持不变,则( )
A.反应过程中得到6.72L的气体(标准状况)
B.最终得到的溶液中溶质为NaCl和NaOH
C.最终得到15.6g的沉淀
D.最终得到的溶液中NaCl的物质的量浓度为1.5mol/L
【答案】D
【解析】解:已知:15.6gNa2O2的物质的量为 ![]() =0.2mol,5.4gAl的物质的量为
=0.2mol,5.4gAl的物质的量为 ![]() =0.2mol,6.72LHCl气体的物质的量为
=0.2mol,6.72LHCl气体的物质的量为 ![]() =0.3mol, 所发生的有关反应为2Na2O2+2H2O═4NaOH+O2↑;2Al+2H2O+2NaOH═2NaAlO2+3H2↑;HCl+NaOH═NaCl+H2O,
=0.3mol, 所发生的有关反应为2Na2O2+2H2O═4NaOH+O2↑;2Al+2H2O+2NaOH═2NaAlO2+3H2↑;HCl+NaOH═NaCl+H2O,
A、2Na2O2+2H2O═4NaOH+O2↑
0.2mol 2.24L
2Al+2H2O+2NaOH═2NaAlO2+3H2↑
0.2mol 6.72L
反应中共得到气体的体积为2.24L+6.72L=8.96L,故A错误;
B、将15.6gNa2O2和5.4gAl同时放入一定量的水中,反应后溶液的成分为0.2molNaOH和0.2molNaAlO2 , 加入0.3molHCl,反应后溶液的成分是0.3molNaCl和0.1molNaAlO2 , 故B错误;
C、反应后溶溶液的成分是0.3molNaCl和0.1molNaAlO2 , 生成0.1mol氢氧化铝沉淀,质量为7.8g,故C错误;
D、由氯元素守恒可知反应后生成0.3molNaCl,则浓度为 ![]() =1.5mol/L,故D正确.
=1.5mol/L,故D正确.
故选D.
【考点精析】利用铝的化学性质对题目进行判断即可得到答案,需要熟知很快与O2反应,形成致密氧化膜,抗腐蚀性比镁强;在纯氧中或高温下可燃烧;与沸水只有微弱反应.

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】T℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如下图所示.已知:物质A、B、C均为气态,D为固态,正反应是吸热反应。
根据要求回答下列问题:
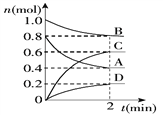
(1)容器中反应的化学方程式为_________________________________.
(2)前2 min,v(A)=___________mol/(L·min)
(3)能说明该反应已达到平衡状态的是_________(填字母,下同).
A.混合气体的压强不变 B.混合气体的密度不变
C.消耗0.1 mol B同时生成0.1 mol D D.B的物质的量不变
(4)反应达到平衡后,改变下列措施能使A的转化率增大的是________.
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(5)合成甲醇的主要反应为:CO(g)+2H2(g)![]() CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
T/℃ | T1 | T2 | T3 |
K | 1/1000 | 1/40 | 25 |
T1、T2、T3的大小关系为__________________________
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);电解池:2Al+3H2O ![]() Al2O3+3H2↑,电解过程中,以下判断正确的是( )
Al2O3+3H2↑,电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e﹣=Pb2++2H2O | 阳极:2Al+3H2O﹣6e﹣=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D