题目内容
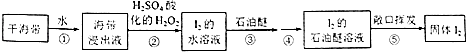
【题目】如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中有黑色现象出现.过一段时间后,经硫酸酸化的高锰酸钾溶液褪色.经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O. 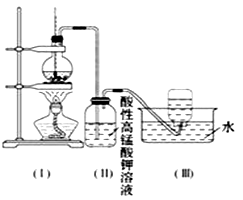
酸性高锰酸钾溶液褪色,甲同学认为能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为不能证明乙烯被酸性高锰酸钾溶液氧化了.
(1)写出乙醇制取乙烯的反应原理: .
(2)你认为哪个同学的观点正确?(填“甲”或“乙”),理由是(从下列选项中选) A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了氧化反应
B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了加成反应
C.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,不能证明通入的气体是纯净物
D.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,只能证明通入的气体一定具有还原性
(3)丙同学取(Ⅱ)瓶中少量溶液于试管里,加入盐酸和氯化钡溶液,产生白色沉淀,他认为乙烯中一定混有二氧化硫,你认为他的结论是否可靠?(填“可靠”或“不可靠”);理由是 .
(4)丁同学想证明乙烯能否与溴发生反应,于是对上述实验进行了改进,改进的方法是:在装置(Ⅰ)和(Ⅱ)之间增加一个装有足量的洗气瓶,且将(Ⅱ)瓶中溶液换成 . 发生加成反应的化学方程式为 .
【答案】
(1)CH3CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
(2)乙;CD
(3)不可靠;硫酸酸化的高锰酸钾溶液中本身就含有SO42﹣
(4)NaOH溶液;溴的四氯化碳溶液;CH2=CH2+Br2→CH2Br﹣CH2Br
【解析】解:(1)乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体,反应的化学方程式为:CH3CH2OH ![]() CH2=CH2↑+H2O,所以答案是:CH3CH2OH
CH2=CH2↑+H2O,所以答案是:CH3CH2OH ![]() CH2=CH2↑+H2O;(2)浓硫酸具有强氧化性,能氧化乙醇,把乙醇氧化成碳,同时自身被还原成二氧化硫,二氧化硫与高锰酸钾反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4褪色,乙烯被高锰酸钾溶液氧化5CH2=CH2+12KMnO+18H2SO4→10CO2+12MnSO4+28H2O+6K2SO4 , 导致高锰酸钾溶液褪色;A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,可能是二氧化硫与高锰酸钾反应,故A错误;B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,可能是乙烯被高锰酸钾氧化,故B错误;C.能使高锰酸钾褪色的有二氧化硫和乙烯,所以不能证明通入的气体是纯净物,故C正确;D.无论是二氧化硫,还是乙烯,使高锰酸钾褪色,都是与高锰酸钾发生氧化还原反应,且高锰酸钾是氧化剂,气体是还原剂具有还原性,故D正确;所以答案是:乙;CD;(3)装置(Ⅱ)中装有经硫酸酸化的高锰酸钾溶液,酸化引入硫酸根离子,加入盐酸和氯化钡溶液,产生白色沉淀,不能说明是二氧化硫被高锰酸钾氧化所得, 所以答案是:不可靠;硫酸酸化的高锰酸钾溶液中本身就含有SO42﹣;(4)氢氧化钠溶液可除掉二氧化硫,溴的四氯化碳溶液褪色可证明乙烯能发生加成反应,
CH2=CH2↑+H2O;(2)浓硫酸具有强氧化性,能氧化乙醇,把乙醇氧化成碳,同时自身被还原成二氧化硫,二氧化硫与高锰酸钾反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4褪色,乙烯被高锰酸钾溶液氧化5CH2=CH2+12KMnO+18H2SO4→10CO2+12MnSO4+28H2O+6K2SO4 , 导致高锰酸钾溶液褪色;A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,可能是二氧化硫与高锰酸钾反应,故A错误;B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,可能是乙烯被高锰酸钾氧化,故B错误;C.能使高锰酸钾褪色的有二氧化硫和乙烯,所以不能证明通入的气体是纯净物,故C正确;D.无论是二氧化硫,还是乙烯,使高锰酸钾褪色,都是与高锰酸钾发生氧化还原反应,且高锰酸钾是氧化剂,气体是还原剂具有还原性,故D正确;所以答案是:乙;CD;(3)装置(Ⅱ)中装有经硫酸酸化的高锰酸钾溶液,酸化引入硫酸根离子,加入盐酸和氯化钡溶液,产生白色沉淀,不能说明是二氧化硫被高锰酸钾氧化所得, 所以答案是:不可靠;硫酸酸化的高锰酸钾溶液中本身就含有SO42﹣;(4)氢氧化钠溶液可除掉二氧化硫,溴的四氯化碳溶液褪色可证明乙烯能发生加成反应,
所以答案是:为除去二氧化硫气体,在装置(Ⅰ)和(Ⅱ)之间增加一个装有足量NaOH溶液的洗气瓶,将装置(Ⅱ)换成盛有溴的四氯化碳溶液的洗气瓶,溴的四氯化碳溶液褪色可证明乙烯能发生加成反应.反应的化学方程式CH2=CH2+Br2→CH2Br﹣CH2Br,
所以答案是:NaOH溶液;溴的四氯化碳溶液;CH2=CH2+Br2→CH2Br﹣CH2Br.

 阶梯计算系列答案
阶梯计算系列答案【题目】T℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如下图所示.已知:物质A、B、C均为气态,D为固态,正反应是吸热反应。
根据要求回答下列问题:
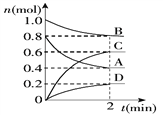
(1)容器中反应的化学方程式为_________________________________.
(2)前2 min,v(A)=___________mol/(L·min)
(3)能说明该反应已达到平衡状态的是_________(填字母,下同).
A.混合气体的压强不变 B.混合气体的密度不变
C.消耗0.1 mol B同时生成0.1 mol D D.B的物质的量不变
(4)反应达到平衡后,改变下列措施能使A的转化率增大的是________.
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(5)合成甲醇的主要反应为:CO(g)+2H2(g)![]() CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
T/℃ | T1 | T2 | T3 |
K | 1/1000 | 1/40 | 25 |
T1、T2、T3的大小关系为__________________________
【题目】关于下列材料说法不正确是( )
序号 | 材料 | 类别 | 性能 | 用途 |
A | 钛合金 | 金属材料 | 密度小,强度高 | 制飞机机翼 |
B | 普通玻璃 | 硅酸盐材料 | 熔点高,透明 | 制试管、烧杯 |
C | 压电陶瓷 | 半导体材料 | 具有压电效应 | 声纳、地震仪 |
D | 氮化硅陶瓷 | 新型无机非金属材料 | 硬度高,耐磨 | 制发动机 |
A. AB. BC. CD. D