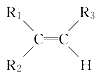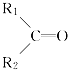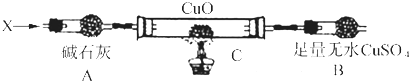题目内容
【题目】根据题目要求填空:
(1)Mg2+的结构示意图为;O的电子式为;H2S的结构式为 .
(2)氯化钠的电子式为 , 溶于水发生电离的电离方程式为 , 向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为 .
【答案】
(1)![]() ;
;![]() ;H﹣S﹣H
;H﹣S﹣H
(2)![]() ;NaCl=Na++Cl﹣;Ag++Cl﹣=AgCl↓
;NaCl=Na++Cl﹣;Ag++Cl﹣=AgCl↓
【解析】解:(1)Mg2+的质子数为12,电子数为10,离子结构示意图为: ![]() ;氧原子最外层为6个电子,O的电子式为:
;氧原子最外层为6个电子,O的电子式为: ![]() ,H2S分子中有2对共用电子对,则H2S结构式H﹣S﹣H,故答案为:
,H2S分子中有2对共用电子对,则H2S结构式H﹣S﹣H,故答案为: ![]() ;
; ![]() ;H﹣S﹣H;(2)氯化钠是由钠离子和氯离子构成的,其电子式为:
;H﹣S﹣H;(2)氯化钠是由钠离子和氯离子构成的,其电子式为: ![]() ,氯化钠为强电解质,完全电离为钠离子、氯离子,电离方程式为:NaCl=Na++Cl﹣ , 向氯化钠溶液中滴入硝酸银,银离子和氯离子反应生成氯化银,离子反应为:Ag++Cl﹣=AgCl↓, 故答案为:
,氯化钠为强电解质,完全电离为钠离子、氯离子,电离方程式为:NaCl=Na++Cl﹣ , 向氯化钠溶液中滴入硝酸银,银离子和氯离子反应生成氯化银,离子反应为:Ag++Cl﹣=AgCl↓, 故答案为: ![]() ;NaCl=Na++Cl﹣;Ag++Cl﹣=AgCl↓.
;NaCl=Na++Cl﹣;Ag++Cl﹣=AgCl↓.
(1)Mg2+的质子数为12,电子数为10,用小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数;氧原子最外层为6个电子,据此书写电子式;H2S分子中有2对共用电子对,据此书写H2S分子的结构式;(2)氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,氯化钠属于强电解质,完全电离出钠离子和氯离子,氯化钠溶液中滴入硝酸银溶液发生复分解反应生成氯化银沉淀.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案【题目】氨的合成是一项重要的化工生产.已知合成氨有关能量变化的图象如图1.
(1)反应N2(g)+3H2(g) ![]() 2NH3(g)△H=KJ/mol;
2NH3(g)△H=KJ/mol;
(2)已知键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | X | 946 |
则表中X的值是 .
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是 .
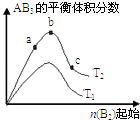
【题目】T℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如下图所示.已知:物质A、B、C均为气态,D为固态,正反应是吸热反应。
根据要求回答下列问题:
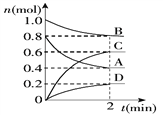
(1)容器中反应的化学方程式为_________________________________.
(2)前2 min,v(A)=___________mol/(L·min)
(3)能说明该反应已达到平衡状态的是_________(填字母,下同).
A.混合气体的压强不变 B.混合气体的密度不变
C.消耗0.1 mol B同时生成0.1 mol D D.B的物质的量不变
(4)反应达到平衡后,改变下列措施能使A的转化率增大的是________.
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(5)合成甲醇的主要反应为:CO(g)+2H2(g)![]() CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
T/℃ | T1 | T2 | T3 |
K | 1/1000 | 1/40 | 25 |
T1、T2、T3的大小关系为__________________________