题目内容
【题目】下列有关物质性质与用途具有对应关系的是
A.氨气具有还原性,可用作制冷剂
B.次氯酸具有弱酸性,可用作有色物质的漂白剂
C.浓硫酸具有强氧化性,可用作酯化反应的催化剂
D.碳酸钠溶液显碱性,可用其热溶液除去金属餐具表面油污
【答案】D
【解析】
A.还原性是化学性质,可作制冷剂是利用其物理性质,A项错误;
B.次氯酸具有漂白性是因为其氧化性,与酸性无关,B项错误;
C.酯化反应并非氧化还原反应,因此利用的不是浓硫酸的强氧化性,C项错误;
D.纯碱溶液具有碱性,油污在碱性环境下易水解,形成水溶性物质,因此可用纯碱溶液来除去油污,D项正确;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】T℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如下图所示.已知:物质A、B、C均为气态,D为固态,正反应是吸热反应。
根据要求回答下列问题:
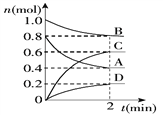
(1)容器中反应的化学方程式为_________________________________.
(2)前2 min,v(A)=___________mol/(L·min)
(3)能说明该反应已达到平衡状态的是_________(填字母,下同).
A.混合气体的压强不变 B.混合气体的密度不变
C.消耗0.1 mol B同时生成0.1 mol D D.B的物质的量不变
(4)反应达到平衡后,改变下列措施能使A的转化率增大的是________.
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(5)合成甲醇的主要反应为:CO(g)+2H2(g)![]() CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
T/℃ | T1 | T2 | T3 |
K | 1/1000 | 1/40 | 25 |
T1、T2、T3的大小关系为__________________________