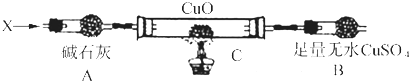题目内容
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A. 17gOH-中含有的电子数为NA
B. 6.5gZn与足量盐酸反应失去的电子数为0.2NA
C. 1L1mol/LCaC12溶液中含有的Cl-离子数目为NA
D. 常温常压下,11.2LO2中含有的原子数目为NA
【答案】B
【解析】A、n(OH-)=![]() =1 mol,1个OH-中含有的10个电子,1 molOH-中含有的10NA个电子;A项错误;B、n(Zn)=
=1 mol,1个OH-中含有的10个电子,1 molOH-中含有的10NA个电子;A项错误;B、n(Zn)= ![]() =0.1 mol,与盐酸反应Zn转化成Zn2+,0.1mol转移电子数0.2NA个电子,B项正确;C、1 mol·L-1CaCl2溶液的体积不确定,其中含有的Cl-数目也不能确定,C项错误;D、非标准状况不能利用22.4 L/mol求算O2的物质的量,进而求原子数,D项错误。答案选B。
=0.1 mol,与盐酸反应Zn转化成Zn2+,0.1mol转移电子数0.2NA个电子,B项正确;C、1 mol·L-1CaCl2溶液的体积不确定,其中含有的Cl-数目也不能确定,C项错误;D、非标准状况不能利用22.4 L/mol求算O2的物质的量,进而求原子数,D项错误。答案选B。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】氨的合成是一项重要的化工生产.已知合成氨有关能量变化的图象如图1.
(1)反应N2(g)+3H2(g) ![]() 2NH3(g)△H=KJ/mol;
2NH3(g)△H=KJ/mol;
(2)已知键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | X | 946 |
则表中X的值是 .
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是 .
【题目】T℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如下图所示.已知:物质A、B、C均为气态,D为固态,正反应是吸热反应。
根据要求回答下列问题:
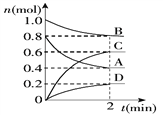
(1)容器中反应的化学方程式为_________________________________.
(2)前2 min,v(A)=___________mol/(L·min)
(3)能说明该反应已达到平衡状态的是_________(填字母,下同).
A.混合气体的压强不变 B.混合气体的密度不变
C.消耗0.1 mol B同时生成0.1 mol D D.B的物质的量不变
(4)反应达到平衡后,改变下列措施能使A的转化率增大的是________.
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(5)合成甲醇的主要反应为:CO(g)+2H2(g)![]() CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
T/℃ | T1 | T2 | T3 |
K | 1/1000 | 1/40 | 25 |
T1、T2、T3的大小关系为__________________________
【题目】关于下列材料说法不正确是( )
序号 | 材料 | 类别 | 性能 | 用途 |
A | 钛合金 | 金属材料 | 密度小,强度高 | 制飞机机翼 |
B | 普通玻璃 | 硅酸盐材料 | 熔点高,透明 | 制试管、烧杯 |
C | 压电陶瓷 | 半导体材料 | 具有压电效应 | 声纳、地震仪 |
D | 氮化硅陶瓷 | 新型无机非金属材料 | 硬度高,耐磨 | 制发动机 |
A. AB. BC. CD. D
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);电解池:2Al+3H2O ![]() Al2O3+3H2↑,电解过程中,以下判断正确的是( )
Al2O3+3H2↑,电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e﹣=Pb2++2H2O | 阳极:2Al+3H2O﹣6e﹣=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D