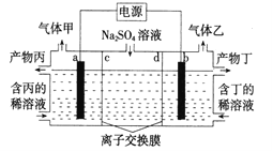
题目内容
【题目】CO2在工业中有重要的用途,请回答:
I.用CrO3作催化剂,CO2重整乙烷(C2H6)制乙烯(C2H4)的反应过程如下:
①C2H6(g)![]() C2H4(g)+H2(g) ΔH1;
C2H4(g)+H2(g) ΔH1;
②3H2(g)+2CrO3(s) =3H2O(g)+Cr2O3(s) ΔH2;
③Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) ΔH3;
(1)反应C2H6(g)+CO2(g)![]() C2H4(g)+CO(g)+H2O(g)的反应热ΔH=____________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
C2H4(g)+CO(g)+H2O(g)的反应热ΔH=____________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)向2L的恒容密闭容器中充入0.1molC2H6(g)和0.1molCO2(g),发生(1)中反应,C2H6(g)的平衡转化率[a(C2H6)]与温度(T)的关系如图所示。
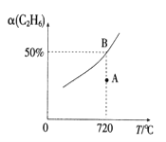
①在相应温度下,A点的反应速v(正)____v(逆)(填“>”、“<”或“=”)。
②若不考虑副反应的发生,为提高α(C2H6),除了将生成物及时从体系中分离出来外,还可采取的措施有___________(任写一种)。
Ⅱ.在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(3)该反应为_________反应(填“吸热”、“放热”),原因为_________________。
(4)830℃下,若向容器中分别加入2molH2和2molCO2,10s后达到平衡,则这段时间内v(H2)=________,转化率α(CO2)=___________。
【答案】![]() > 适当升高温度(或适当减小压强或增大起始时CO2与C2H6的投料比等其他合理答案) 吸热 温度升高,平衡常数增大,平衡正向移动,则正反应吸热 0.05mol/(Ls) 50%
> 适当升高温度(或适当减小压强或增大起始时CO2与C2H6的投料比等其他合理答案) 吸热 温度升高,平衡常数增大,平衡正向移动,则正反应吸热 0.05mol/(Ls) 50%
【解析】
I.(1)根据盖斯定律计算;
(2)①图象可知曲线上的点为平衡点,A点位于曲线下,达到平衡需要增大乙烷的转化率;
②为提高C2H6的平衡转化率,平衡正向进行。
II.(3)根据表中数据分析,温度升高,化学平衡常数增大,说明温度升高促进反应正向进行;
(4)根据v=![]() 计算H2的消耗速率,由α=
计算H2的消耗速率,由α=![]() ×100%计算CO2的平衡转化率。
×100%计算CO2的平衡转化率。
I.(1)①C2H6(g)![]() C2H4(g) + H2(g) ΔH1;
C2H4(g) + H2(g) ΔH1;
②3H2(g) + 2CrO3(s) = 3H2O(g) + Cr2O3(s) ΔH2;
③Cr2O3(s) + 3CO2(g) = 3CO(g) + 2CrO3(s) ΔH3;
盖斯定律计算![]() (①×3+②+③)得到反应:C2H6(g)+CO2(g)
(①×3+②+③)得到反应:C2H6(g)+CO2(g)![]() C2H4(g)+CO2(g)+H2O(g)的△H=
C2H4(g)+CO2(g)+H2O(g)的△H=![]() ;
;
(2)①C2H6的平衡转化率与温度的关系图分析可知,A点位于平衡曲线下方,未达到化学平衡,若达到平衡状态需要增大乙烷的转化率,所以反应正向进行,A点的反应速率v(正)>v(逆);
②若不考虑副反应的发生,为提高C2H6的平衡转化率,除了将生成物及时从体系中分离出来外,还可采取的措施有:适当升高温度或适当减小压强或增大起始时CO2与C2H6的投料比等。
II.(3)根据表中数据分析,温度升高,化学平衡常数增大,说明升高温度,促进反应正向进行,则正反应为吸热反应;
(4)在2L密闭容器中发生反应CO2(g)+H2(g)![]() CO(g)+H2O(g),在反应开始时n(CO2)=n(H2)=2mol,假设反应产生H2O的物质的量为x,则根据物质反应转化关系可知平衡时的物质的量:n(CO2)=n(H2)=(2-x)mol,n(CO)=n(H2O)=xmol,由于反应前后气体的物质的量相等,在830℃下,K=1.0,所以K=
CO(g)+H2O(g),在反应开始时n(CO2)=n(H2)=2mol,假设反应产生H2O的物质的量为x,则根据物质反应转化关系可知平衡时的物质的量:n(CO2)=n(H2)=(2-x)mol,n(CO)=n(H2O)=xmol,由于反应前后气体的物质的量相等,在830℃下,K=1.0,所以K=![]() =
=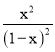 =1.0,解得x=1mol,则这段时间内v(H2)=
=1.0,解得x=1mol,则这段时间内v(H2)=![]() =0.05mol/(Ls),此时CO2的转化率α(CO2)=
=0.05mol/(Ls),此时CO2的转化率α(CO2)=![]() ×100%=50%。
×100%=50%。

 高中必刷题系列答案
高中必刷题系列答案【题目】在25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀。最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
AgCl | AgI | Ag2S | |
Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同