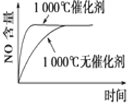
题目内容
【题目】2008年12月15日,全球第一款不依赖专业充电站的双模电动车--比亚迪F3DM双模电动车在深圳正式上市.比亚迪F3DM双模电动车代表着“科技![]() 绿色明天”,运用了众多高新科技,开启了电动车的新时代,同时也实现了中国力量领跑世界.镍镉
绿色明天”,运用了众多高新科技,开启了电动车的新时代,同时也实现了中国力量领跑世界.镍镉![]() 可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:![]() 有关该电池的说法正确的()
有关该电池的说法正确的()
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应:![]()
C.放电时负极附近溶液的酸性增强
D.放电时电解质溶液中的![]() 向正极移动
向正极移动
【答案】B
【解析】
A、充电过程是电解池,是电能转化为化学能的过程,故A错误;
B、充电时阳极反应是![]() ,故B正确;
,故B正确;
C、放电时负极上发生氧化反应,![]() ,电极附近溶液的碱性减弱,故C错误;
,电极附近溶液的碱性减弱,故C错误;
D、放电时,电解质溶液中![]() 向负极移动,故D错误;
向负极移动,故D错误;
故选B。

 53天天练系列答案
53天天练系列答案【题目】CO2在工业中有重要的用途,请回答:
I.用CrO3作催化剂,CO2重整乙烷(C2H6)制乙烯(C2H4)的反应过程如下:
①C2H6(g)![]() C2H4(g)+H2(g) ΔH1;
C2H4(g)+H2(g) ΔH1;
②3H2(g)+2CrO3(s) =3H2O(g)+Cr2O3(s) ΔH2;
③Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) ΔH3;
(1)反应C2H6(g)+CO2(g)![]() C2H4(g)+CO(g)+H2O(g)的反应热ΔH=____________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
C2H4(g)+CO(g)+H2O(g)的反应热ΔH=____________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
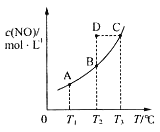
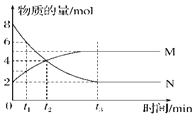
(2)向2L的恒容密闭容器中充入0.1molC2H6(g)和0.1molCO2(g),发生(1)中反应,C2H6(g)的平衡转化率[a(C2H6)]与温度(T)的关系如图所示。
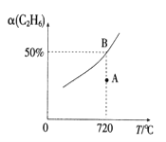
①在相应温度下,A点的反应速v(正)____v(逆)(填“>”、“<”或“=”)。
②若不考虑副反应的发生,为提高α(C2H6),除了将生成物及时从体系中分离出来外,还可采取的措施有___________(任写一种)。
Ⅱ.在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(3)该反应为_________反应(填“吸热”、“放热”),原因为_________________。
(4)830℃下,若向容器中分别加入2molH2和2molCO2,10s后达到平衡,则这段时间内v(H2)=________,转化率α(CO2)=___________。
【题目】某化学兴趣小组设计如下实验方案,将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示:
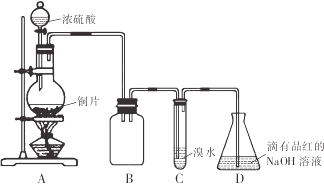
请回答下列问题:
(1)装置B的作用是______。
(2)设计装置C的目的是验证SO2的______性,装置C中发生反应的离子方程式是______装置D中NaOH全部转化为NaHSO3的标志是______。
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
序号 | 实验操作 | 现象 | 结论 |
① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
② | 滴加少量淀粉KI溶液,振荡 | _______ | Ⅲ |
③ | 滴加少量溴水,振荡 | _________ | Ⅱ |
④ | 滴加少量酸性KMnO4溶液、振荡 | 溶液为紫色 | ____ |
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb,的相对大小:___。