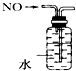题目内容
【题目】Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是________。欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________。若电解电路中通过2 mol电子,MnO2的理论产量为________。
(4)用间接电化学法除去NO的过程,如下图所示:

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:_____________。用离子方程式表示吸收池中除去NO的原理:____________________________________。
【答案】 Zn(或锌) 正极 Zn与Cu2+反应生成Cu,Zn与Cu构成原电池,加快反应速率 b 2H++2e-=H2↑ 87g 2HSO3- + 2e- + 2H+ === S2O42- + 2H2O 2NO + 2S2O42- +2H2O === N2 + 4HSO3-
【解析】本题主要考查原电池原理。
(1)该电池的负极材料是锌。电池工作时,电子由负极流向正极。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是Zn与Cu2+反应生成Cu,Zn与Cu构成原电池,加快反应速率。欲除去Cu2+,最好选用下列试剂中的Zn,可以防止产生杂质离子。
(3)阴极的电极反应式是2H++2e-=H2↑。若电解电路中通过2mol电子,MnSO4~MnO2~2e-,MnO2的理论产量为1mol即87g。
(4)阴极室溶液呈酸性,阴极的电极反应式:2HSO3-+2e-+2H+=S2O42-+2H2O。用离子方程式表示吸收池中除去NO的原理:2NO+2S2O42-+2H2O=N2+4HSO3-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】将a气体通入b溶液中,实验现象描述正确的组合是( )
a气体 | b溶液 | 预测的现象 | |
① | CO2 | BaCl2溶液 | 白色沉淀析出 |
② | SO2 | Ba(NO3)2 溶液 | 白色沉淀析出 |
③ | Br2 | AgNO3溶液 | 淡黄色沉淀析出 |
④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
A.①②③
B.②③④
C.①②④
D.①③④