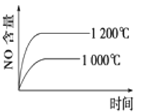
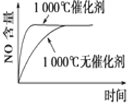
题目内容
【题目】醋酸是一种常见的弱酸,请回答:
(1)已知某温度时,醋酸的电离平衡常数Ka=1.6×10-5。
①醋酸的起始浓度为0.010mol/L,平衡时c(H+)=______(提示:醋酸的电离平衡常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010mol/L
②pH=1的醋酸与pH=l的盐酸等体积混合,混合后溶液中c(CH3COO-)=_______。
(2)日常生活中常用醋酸除水垢,但工业锅炉的水垢中常含有CaSO4,需先用________(填化学式)溶液处理,而后用盐酸去除。
【答案】4×10-4 mol/L 0.05mol/L Na2CO3
【解析】
(1)①结合电离平衡常数Ka=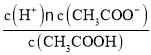 计算;
计算;
②pH=1的醋酸与pH=l的盐酸等体积混合,氢离子浓度相同,醋酸电离平衡不变,混合后溶液中c(CH3COO-)为原醋酸浓度的一半;
(2)从难溶电解质的转化的角度分析,硫酸钙溶解性大于碳酸钙,转化为更难溶的除去。
(1)①醋酸是一元弱酸,在溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,醋酸的电离平衡常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010mol/L,电离平衡常数Ka=
CH3COO-+H+,醋酸的电离平衡常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010mol/L,电离平衡常数Ka=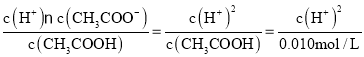 =1.6×10-5,所以c(H+)=4.0×10-4mol/L;
=1.6×10-5,所以c(H+)=4.0×10-4mol/L;
②pH=1的醋酸与pH=l的盐酸等体积混合,溶液中氢离子浓度相同,醋酸电离平衡不变,由于溶液的体积是原来的2倍,所以混合后溶液中c(CH3COO-)为原醋酸浓度的一半为0.05mol/L;
(2)CaSO4较为致密,可转化为较为疏松,且溶解度更小的CaCO3,水垢中含有的CaSO4,可先用Na2CO3溶液处理,而后用酸去除,反应的离子方程式为CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq),故需使用的试剂为Na2CO3溶液。
CaCO3(s)+SO42-(aq),故需使用的试剂为Na2CO3溶液。

【题目】CO2在工业中有重要的用途,请回答:
I.用CrO3作催化剂,CO2重整乙烷(C2H6)制乙烯(C2H4)的反应过程如下:
①C2H6(g)![]() C2H4(g)+H2(g) ΔH1;
C2H4(g)+H2(g) ΔH1;
②3H2(g)+2CrO3(s) =3H2O(g)+Cr2O3(s) ΔH2;
③Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) ΔH3;
(1)反应C2H6(g)+CO2(g)![]() C2H4(g)+CO(g)+H2O(g)的反应热ΔH=____________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
C2H4(g)+CO(g)+H2O(g)的反应热ΔH=____________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)向2L的恒容密闭容器中充入0.1molC2H6(g)和0.1molCO2(g),发生(1)中反应,C2H6(g)的平衡转化率[a(C2H6)]与温度(T)的关系如图所示。
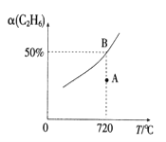
①在相应温度下,A点的反应速v(正)____v(逆)(填“>”、“<”或“=”)。
②若不考虑副反应的发生,为提高α(C2H6),除了将生成物及时从体系中分离出来外,还可采取的措施有___________(任写一种)。
Ⅱ.在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(3)该反应为_________反应(填“吸热”、“放热”),原因为_________________。
(4)830℃下,若向容器中分别加入2molH2和2molCO2,10s后达到平衡,则这段时间内v(H2)=________,转化率α(CO2)=___________。