题目内容
12.一定条件下,在体积一定的密闭容器中加入1mol N2和3mol H2发生反应:N2 (g)+3H2 (g)$?_{催化剂}^{高温高压}$2NH3 (g)△H=-92kJ/mol.下列有关说法正确的是( )| A. | 降低温度可以使平衡正向移动,可以加快反应速率 | |
| B. | 达到化学反应限度时,生成2mol NH3 | |
| C. | 向容器中再加入N2,可以加快反应速率 | |
| D. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 |
分析 A、降温化学反应速率减慢;
B、可逆反应的反应物不能完全转化;
C、增大浓度,反应速率加快;
D、反应放热,说明反应物能量高于生成物.
解答 解:A、降温化学反应速率减慢,故A错误;
B、合成氨是可逆反应,可逆反应的反应物不能完全转化为生成物,所以1mol N2和3mol H2发生反应生成的氨气少于2mol,故B错误;
C、增大浓度,反应速率加快,在体积一定的密闭容器中再加入 N2反应速率加快,故C正确;
D、反应放热,说明1mol N2和3mol H2的总能量高于2mol NH3的总能量,故D错误;
故选C.
点评 本题考查了影响化学反应速率的因素、可逆反应的特点、反应焓变与反应物生成物能量关系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列离子在溶液中可以大量共存的一组是( )
| A. | Na+ NO3- SO42- | B. | Ag+ NO3- Cl- | ||
| C. | K+ H+ HCO3- | D. | NH4+ Na+ OH- |
13.类比推理的方法是化学学习与研究中有广泛的应用,但有时会得出错误的结论,以下几种类比推理结论中正确的是( )
| A. | H2SO4为强酸,推出HClO4为强酸 | |
| B. | Fe3Cl8可以改写为FeCl2 •2FeCl3,推出Fe3I8可以改写为FeI2 •2FeI3 | |
| C. | NH3的沸点高于PH3,推出CH4沸点高于SiH4 | |
| D. | CO2 通入Ba(NO3)2 溶液中无沉淀生成,推出SO2通入Ba(NO3)2 溶液中无沉淀生成 |
10.某有机样品3.1g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1g,经过滤得到10g沉淀,该有机样品可能是( )
| A. | 乙酸 | B. | 乙醇 | ||
| C. | 乙醛 | D. | 甲醇和丙三醇的混合物 |
7.下列实验过程中,溶液的pH减小的是( )
| A. | 以碳棒为两极电解氢氧化钠溶液 | B. | 向稀盐酸中滴加NaOH溶液 | ||
| C. | 以碳棒为两极电解饱和氯化钠溶液 | D. | 向氢氧化钠溶液中加水 |
17.分子式为C9H18O2的有机物A能在酸性条件下进行下列转化,同温同压下,相同质量的B和C的蒸气所占体积相同.则下列说法不正确的是( )(A、B、C、D、E均为有机物)
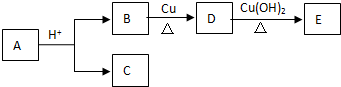

| A. | 符合上述转化关系的有机物A的结构有8种 | |
| B. | C和E一定为同系物 | |
| C. | 1molB完全转化为D转移2mol电子 | |
| D. | D到E发生氧化反应 |
4.某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在纸片上,不对应,需整理):
请帮助该同学整理并完成实验报告.
(1)实验目的:验证Na、Mg、Al、S、Cl元素从左到右金属性依次减弱、非金属性依次增强的规律.
(2)实验用品:试管、酒精灯、砂纸、镊子、小刀、胶头滴管.
(3)实验内容:
(4)实验结论:同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强.
(5)请用物质结构理论简单说明具有上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动随之消失,溶液变成红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | C.反应不十分剧烈,产生气体可以在空气中燃烧 |
| ④镁带与2mol•L-1的盐酸反应 | D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2mol•L-1的盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠 | F.生成淡黄色沉淀 |
(1)实验目的:验证Na、Mg、Al、S、Cl元素从左到右金属性依次减弱、非金属性依次增强的规律.
(2)实验用品:试管、酒精灯、砂纸、镊子、小刀、胶头滴管.
(3)实验内容:
| 实验方案 (填序号) | 实验现象 (填序号) | 有关化学方程式 |
(5)请用物质结构理论简单说明具有上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
1.下列实验中操作、现象、结论对应关系正确的一组是( )
| 选 项 | 操作 | 现象 | 结论 |
| A | 向稀的苯酚水溶液中滴加浓溴水 | 生成白色沉淀 | 产物三溴苯酚不溶于水 |
| B | 淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 | 产生红色沉淀 | 淀粉水解可生成葡萄糖 |
| C | 溴乙烷和氢氧化钠溶液充分反应后,用足量稀硝酸酸化,再加入硝酸银溶液 | 生成淡黄色沉淀 | 溴乙烷中含有溴元素 |
| D | 将溴水加入苯中并充分振荡 | 溴水褪色 | 苯与溴发生了取代反应 |
| A. | A | B. | B | C. | C | D. | D |
2.实验室用Fe2+的废酸液(pH为1.7)制取氧化铁晶体的流程如图所示.下列说法错误的是( )
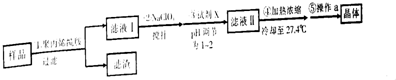

| A. | 步骤①中过滤操作需用到的玻璃仪器为玻璃棒、分液漏斗、烧杯 | |
| B. | 步骤②中搅拌操作可加快散热,减少FeCl3水解 | |
| C. | 步骤③中加入的试剂X为浓盐酸 | |
| D. | 步骤⑤中操作a为过滤、洗涤、干燥 |