题目内容
18.已知NaNO3,Na2CO3,Na3PO4三种溶液中Na+浓度相等,溶液的体积比是3:2:1,求溶液中溶质的物质的量之比.分析 设钠离子浓度为1mol/L,NaNO3、Na2CO3、Na3PO4三溶液体积分别为3L、2L、1L,根据n=cV计算钠离子物质的量,进而计算NaNO3、Na2CO3、Na3PO4的物质的量,可得三者物质的量之比.
解答 解:设钠离子浓度为1mol/L,NaNO3、Na2CO3、Na3PO4三溶液体积分别为3L、2L、1L,
n(NaNO3)=n(Na+)=3L×1mol/L=3mol
n(Na2CO3)=$\frac{1}{2}$n(Na+)=$\frac{1}{2}$×2L×1mol/L=1mol
n(Na3PO4)=$\frac{1}{3}$n(Na+)=$\frac{1}{3}$×1L×1mol/L=$\frac{1}{3}$mol
故NaNO3、Na2CO3、Na3PO4的物质的量之比为3mol:1mol:$\frac{1}{3}$=9:3:1,
答:NaNO3、Na2CO3、Na3PO4的物质的量之比为9:3:1.
点评 本题考查物质的量浓度有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
8.某课外活动小组使用下图装置利用浓盐酸制取氯气并制备一定量的FeCl3,下列说法错误的是( )

| A. | 装置a烧瓶内加入的固体可以是MnO2 | |
| B. | 若按a、e、d、b、c顺序连接装置,则e中盛装的是浓硫酸 | |
| C. | 制备过程中装置b硬质玻璃管内有红棕色的烟产生 | |
| D. | 验证产物中的Fe3+存在可使用KSCN溶液 |
9.下列每组中两种物质反应时,无论哪种过量都可用同一离子方程式表示的是( )
| A. | FeBr2溶液与Cl2 | B. | Ca(HCO3)2溶液与KOH溶液 | ||
| C. | NaHCO3溶液与Al2(SO4)3溶液 | D. | NaHSO4溶液与Ba(OH)2溶液 |
6.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 32g O2所含的原子数目为NA | |
| B. | 0.5mol H2O所含有的原子数为0.5NA | |
| C. | 1mol H2含有的原子数目为2NA | |
| D. | 0.5NA个氧气分子的物质的量是0.5mol |
13.类比推理的方法是化学学习与研究中有广泛的应用,但有时会得出错误的结论,以下几种类比推理结论中正确的是( )
| A. | H2SO4为强酸,推出HClO4为强酸 | |
| B. | Fe3Cl8可以改写为FeCl2 •2FeCl3,推出Fe3I8可以改写为FeI2 •2FeI3 | |
| C. | NH3的沸点高于PH3,推出CH4沸点高于SiH4 | |
| D. | CO2 通入Ba(NO3)2 溶液中无沉淀生成,推出SO2通入Ba(NO3)2 溶液中无沉淀生成 |
3.下列关于SO2和CO2的说法不正确的是( )
| A. | SO2和CO2均是酸酐 | |
| B. | SO2能使品红溶液褪色而CO2则不能 | |
| C. | SO2和CO2均能跟石灰水反应生成白色沉淀 | |
| D. | SO2和CO2均既有氧化性又有还原性 |
10.某有机样品3.1g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1g,经过滤得到10g沉淀,该有机样品可能是( )
| A. | 乙酸 | B. | 乙醇 | ||
| C. | 乙醛 | D. | 甲醇和丙三醇的混合物 |
17.分子式为C9H18O2的有机物A能在酸性条件下进行下列转化,同温同压下,相同质量的B和C的蒸气所占体积相同.则下列说法不正确的是( )(A、B、C、D、E均为有机物)
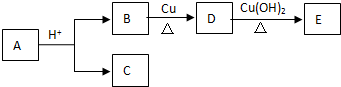

| A. | 符合上述转化关系的有机物A的结构有8种 | |
| B. | C和E一定为同系物 | |
| C. | 1molB完全转化为D转移2mol电子 | |
| D. | D到E发生氧化反应 |
18.将一定量的A、B物质充入一密闭容器中,发生如下反应A(g)+3B(g)?2C(g),3min后测得C浓度为0.6mol•L-1,则此时间内用C表示的反应速率正确的是( )
| A. | 0.2mol•(L•s)-1 | B. | 0.2mol•(L•min)-1 | C. | 0.6mol•(L•min)-1 | D. | 0.3mol•(L•min)-1 |