题目内容
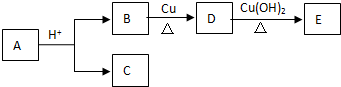
9. 已知A、B、C、D是中学化学中常见的四种不同微粒.它们之间存在如图中转化关系:
已知A、B、C、D是中学化学中常见的四种不同微粒.它们之间存在如图中转化关系:(1)如果A、B、C、D均是10电子的微粒,请写出:
A的化学式NH4+(或HF);D的化学式H2O.
(2)如果A和C是18电子的微粒,B和D是10电子的微粒,请写出A与B在溶液中反应的离子方程式H2S+OH-=HS-+H2O(或H2S+2OH-=S2-+2H2O).
分析 (1)10电子微粒A、B反应得到两种10电子微粒,应是NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O(或HF+OH-═F-+H2O),可推知A为NH4+,B为OH-,C为NH3,D为H2O(或A为HF,B为OH-,C为F-,D为H2O);
(2)如果A、C均是18电子的粒子,B、D是10电子粒子,结合转化关系,可推断:A为H2S,B为OH-,C为HS-或S2-,D为H2O.
解答 解:(1)10电子微粒A、B反应得到两种10电子微粒,应是NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O(或HF+OH-═F-+H2O),可推知A为NH4+,B为OH-,C为NH3,D为H2O(或A为HF,B为OH-,C为F-,D为H2O),
故答案为:NH4+(或HF);H2O;
(2)如果A、C均是18电子的粒子,B、D是10电子粒子,结合转化关系,可推断:A为H2S,B为OH-,C为HS-或S2-,D为H2O,A与B在溶液中反应的离子方程式:H2S+OH-=HS-+H2O(或H2S+2OH-=S2-+2H2O),
故答案为:H2S+OH-=HS-+H2O(或H2S+2OH-=S2-+2H2O).
点评 本题考查了常见10电子微粒和18电子微粒的结构和性质应用,主要考查离子反应的结构特征,熟悉10电子微粒和18电子微粒是解题关键.

练习册系列答案
相关题目
9.下列每组中两种物质反应时,无论哪种过量都可用同一离子方程式表示的是( )
| A. | FeBr2溶液与Cl2 | B. | Ca(HCO3)2溶液与KOH溶液 | ||
| C. | NaHCO3溶液与Al2(SO4)3溶液 | D. | NaHSO4溶液与Ba(OH)2溶液 |
10.某有机样品3.1g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1g,经过滤得到10g沉淀,该有机样品可能是( )
| A. | 乙酸 | B. | 乙醇 | ||
| C. | 乙醛 | D. | 甲醇和丙三醇的混合物 |
17.分子式为C9H18O2的有机物A能在酸性条件下进行下列转化,同温同压下,相同质量的B和C的蒸气所占体积相同.则下列说法不正确的是( )(A、B、C、D、E均为有机物)

| A. | 符合上述转化关系的有机物A的结构有8种 | |
| B. | C和E一定为同系物 | |
| C. | 1molB完全转化为D转移2mol电子 | |
| D. | D到E发生氧化反应 |
4.某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在纸片上,不对应,需整理):
请帮助该同学整理并完成实验报告.
(1)实验目的:验证Na、Mg、Al、S、Cl元素从左到右金属性依次减弱、非金属性依次增强的规律.
(2)实验用品:试管、酒精灯、砂纸、镊子、小刀、胶头滴管.
(3)实验内容:
(4)实验结论:同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强.
(5)请用物质结构理论简单说明具有上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动随之消失,溶液变成红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | C.反应不十分剧烈,产生气体可以在空气中燃烧 |
| ④镁带与2mol•L-1的盐酸反应 | D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2mol•L-1的盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠 | F.生成淡黄色沉淀 |
(1)实验目的:验证Na、Mg、Al、S、Cl元素从左到右金属性依次减弱、非金属性依次增强的规律.
(2)实验用品:试管、酒精灯、砂纸、镊子、小刀、胶头滴管.
(3)实验内容:
| 实验方案 (填序号) | 实验现象 (填序号) | 有关化学方程式 |
(5)请用物质结构理论简单说明具有上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
1.下列实验中操作、现象、结论对应关系正确的一组是( )
| 选 项 | 操作 | 现象 | 结论 |
| A | 向稀的苯酚水溶液中滴加浓溴水 | 生成白色沉淀 | 产物三溴苯酚不溶于水 |
| B | 淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 | 产生红色沉淀 | 淀粉水解可生成葡萄糖 |
| C | 溴乙烷和氢氧化钠溶液充分反应后,用足量稀硝酸酸化,再加入硝酸银溶液 | 生成淡黄色沉淀 | 溴乙烷中含有溴元素 |
| D | 将溴水加入苯中并充分振荡 | 溴水褪色 | 苯与溴发生了取代反应 |
| A. | A | B. | B | C. | C | D. | D |
18.将一定量的A、B物质充入一密闭容器中,发生如下反应A(g)+3B(g)?2C(g),3min后测得C浓度为0.6mol•L-1,则此时间内用C表示的反应速率正确的是( )
| A. | 0.2mol•(L•s)-1 | B. | 0.2mol•(L•min)-1 | C. | 0.6mol•(L•min)-1 | D. | 0.3mol•(L•min)-1 |
19.能证明丙烯分子里含有一个碳碳双键的事实是( )
| A. | 丙烯分子里碳氢原子的个数比为1:2 | |
| B. | 丙烯完全燃烧生成的CO2和H2O的物质的量相等 | |
| C. | 丙烯能使酸性KMnO4溶液褪色 | |
| D. | 丙烯易与溴水发生加成反应,且1 mol乙烯完全加成需消耗1 mol溴单质 |