题目内容
20.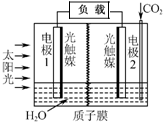 利用人工模拟光合作用合成甲酸的原理为:
利用人工模拟光合作用合成甲酸的原理为:太阳能光触媒2CO2+2H2O $→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
| A. | 电极1周围pH增大 | |
| B. | 电子由电极1经过负载流向电极2 | |
| C. | 电极2的反应式:CO2+2H++2e-=HCOOH | |
| D. | 该装置能将太阳能转化为化学能和电能 |
分析 A.离子交换膜为质子膜,则电解质溶液呈酸性,根据方程式知,该反应中C元素化合价由+4价变为+2价,O元素化合价由-2价变为0价,所以1是负极、2是正极,负极上水失电子生成氢离子和氧气;
B.电子由负极沿导线流向正极;
C.2是正极,正极上二氧化碳得电子和氢离子反应生成HCOOH;
D.通过光照,该装置是太阳能转化为化学能和电能.
解答 解:A.离子交换膜为质子膜,则电解质溶液呈酸性,根据方程式知,该反应中C元素化合价由+4价变为+2价,O元素化合价由-2价变为0价,所以1是负极、2是正极,负极上水失电子生成氢离子和氧气,所以1电极附近氢离子浓度增大,则溶液的pH减小,故A错误;
B.电子由负极沿导线流向正极,1是负极、2是正极,所以电子由电极1经过负载流向电极2,故B正确;
C.2是正极,正极上二氧化碳得电子和氢离子反应生成HCOOH,电极反应式为CO2+2H++2e-=HCOOH,故C正确;
D.通过光照,该装置是太阳能转化为化学能和电能,故D正确;
故选A.
点评 本题考查化学电源新型电池,明确正负极的判断、电极反应式类型及书写、电子流向是解本题关键,难点是电极反应式的书写,题目难度中等.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
13.丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是( )
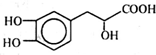

| A. | 丹参素的分子式为C9H10O5 | |
| B. | 1 mol丹参素最多可以和4 mol H2发生加成反应 | |
| C. | 1 mol丹参素在一定条件下与足量金属钠反应可生成2 mol H2 | |
| D. | 丹参素能发生取代、中和、氧化反应等反应 |
12.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1的Na3PO4溶液中:c(Na+)=3c(PO43-)+2c(HPO42-)+c(H2PO4-) | |
| B. | 0.1mol•L-1的NaHS溶液中:c(H+)+c(H2S)=c(OH-)+c(S2-) | |
| C. | 0.1mol•L-1的氨水与0.1mol•L-1的NaHSO4溶液等体积混合:c(Na+ )=c(SO42-)=c(NH4+)>C(H+)>C(OH-) | |
| D. | 0.1mol•L-1的Na2CO3溶液与0.1mol•L-1的NaHCO3溶液等体积混合:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
8.元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T的一种氧化物能使品红溶渡褪色.则下列判断不正确的是( )
| R | X | |
| T | ||
| Z | Q |
| A. | R的单质结构式为: | |
| B. | 工业上以海水为原料,经氧化还原反应制备Q的单质 | |
| C. | 非金属性:Z<T<X | |
| D. | R原子与Z原子的电子数相差26 |
5.关于化学反应与能量的说法中不正确的是( )
| A. | 中和反应是放热反应 | |
| B. | 右图所示的反应为放热反应 | |
| C. | 化学反应中有物质变化也有能量变化 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
12.关于卤素的叙述中,正确的是( )
| A. | 气态氢化物水溶液的酸性依次减弱 | |
| B. | 氯水、溴水、碘水都能使淀粉碘化钾试纸变蓝 | |
| C. | 气态氢化物的稳定性随原子序数的增大而增强 | |
| D. | 原子核外最外层电子数随原子序数的增大而增多 |

 (R1、R2、R3代表烃基或氢原子)
(R1、R2、R3代表烃基或氢原子) .
. .
. .若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).
.若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).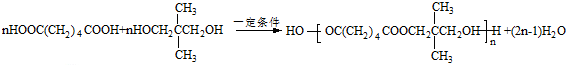 .
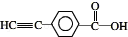
.
 .
.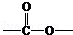 基团
基团 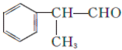 的物质,该物质是一种香料.请根据下述路线,回答下列问题:
的物质,该物质是一种香料.请根据下述路线,回答下列问题: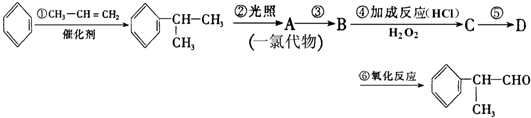
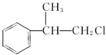 或
或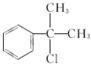 .
. (有机物写结构简式,并注明反应条件).
(有机物写结构简式,并注明反应条件).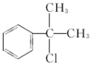 的水解产物
的水解产物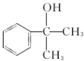 羟基直接相连的碳原子上没有氢原子,不能被氧化,会降低产率.
羟基直接相连的碳原子上没有氢原子,不能被氧化,会降低产率.